科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-13
来源:生物世界
‘生物世界’小编按,6月11日,中国科学院院士、我院院长宋尔卫教授团队在国际顶尖期刊Nature(《自然》)杂志在线发表了题为“DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25”的研究论文。该研究发现肿瘤细胞膜上存在DNA感受器CCDC25,该DNA感受器通过识别胞外NET-DNA介导肿瘤远处转移。

如果把肿瘤比作一颗种子,肿瘤微环境就是让种子生根发芽的土壤。其实,除了肿瘤局部微环境,人体全身都属于肿瘤的生态系统的一部分,远处的器官组织也会与肿瘤发生相互作用,导致的结果就是肿瘤的远处转移。但这一过程究竟是怎样发生的?
中性粒细胞是肿瘤微环境的重要组成部分,在肿瘤的远处器官转移中起着重要作用。既往多项研究发现,中性粒细胞在各种细胞因子、病原微生物或PMA、LPS等化合物刺激下,会将自身的核酸以及蛋白等物质释放出来,形成以DNA为骨架,镶嵌着弹性蛋白酶、髓过氧化物酶等颗粒蛋白的网状样结构,称为中性粒细胞胞外捕获网(Neutrophil Extracellular Traps, NETs)。最初的研究发现,NETs可以捕获病原体,并通过局部高浓度的抗菌蛋白消灭病原体。近年来人们也发现,NETs里面的DNA成分即NET-DNA也参与了肿瘤的远处转移。但之前的研究更多的是集中在动物模型,NET-DNA在肿瘤患者远处器官转移的作用以及临床意义仍不明确。此外,NET-DNA促进肿瘤转移的机制也未得到详细的阐述。
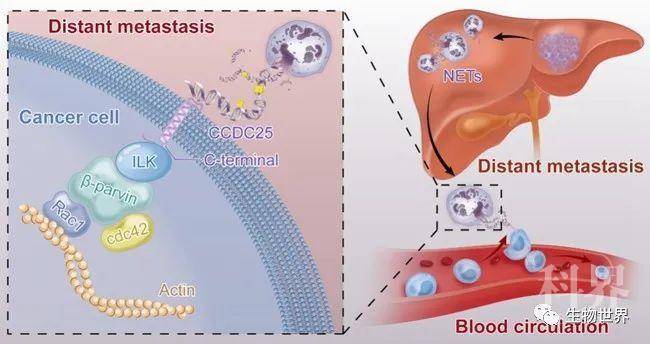
该课题的主要研究设计示意图
该课题组从临床标本出发,发现NETs主要浸润在乳腺癌、结肠癌患者的肝转移组织,且血清NETs可以预测早期乳腺癌患者肝转移的发生,提示在肿瘤发生肝转移前,NETs可能浸润于肝组织并促进肿瘤肝转移的发生。
为了明确NETs是否存在于肿瘤转移前肝组织及作用,该研究通过原位注射以及脾脏注射构建乳腺癌肝转移模型,发现NETs在肿瘤肝转移前就已大量浸润,且随着肝转移过程不断上升。更重要的是,在小鼠体内抑制或者破坏NETs的形成,可以明显减轻乳腺癌肝转移的发生。
在机制方面,该课题组发现NET-DNA可以充当趋化肿瘤细胞运动的趋化因子,在不同小鼠模型中,发现肝脏或者肺组织中的NETs可吸引肿瘤细胞导致远处转移的发生。进一步研究发现,肿瘤细胞膜上存在NET-DNA受体CCDC25,CCDC25通过识别胞外的NET-DNA,激活ILK-β-parvin细胞骨架信号通路,增强肿瘤细胞的运动。既往研究认为DNA感受器主要位于胞内,该研究首次发现存在细胞膜上的DNA感受器。
尚未有研究深入探讨CCDC25在肿瘤细胞中的作用,该蛋白是否可以成为治疗靶点更是不为人知?该课题组通过多种模型进行验证:1.在乳腺癌自发成瘤鼠(MMTV-PyMT)中敲除CCDC25;2.乳腺癌细胞株以及原代乳腺癌细胞敲除CCDC25后接种于小鼠;3.在接种乳腺癌细胞株的小鼠腹腔注射中和抗体。实验结果显示:靶向CCDC25可以减少乳腺癌远处器官转移的发生。因此,该研究为乳腺癌患者远处器官转移提供新的靶点及治疗策略。
来源:MedicineWorld 生物世界
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMjY5MDAwMA==&mid=2247486384&idx=3&sn=b9b1c67fb8fbd9c75b8cac15213494d7&chksm=e828e40fdf5f6d192e99c7cd135a202cd8405c3d1d718324e813b7fc7c4598c1828ce5b0e47b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
第22届全国肿瘤防治宣传周启动仪式在北京举行




什么是乳腺癌?
红细胞膜磷脂
让DNA与细胞膜“聊天”
澳大利亚icon医疗集团访问中国抗癌协会秘书处


中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



中国抗癌协会整合肿瘤学分会成立大会在西安召开




美国MD安德森癌症中心:不容忽视的男性乳腺癌!
乳腺癌个体化诊疗的基础和临床研究

CellReports:武宁教授等揭示细胞膜脂搅乱酶TMEM16F参与细胞膜修复