科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-22
来源:X一MOL资讯
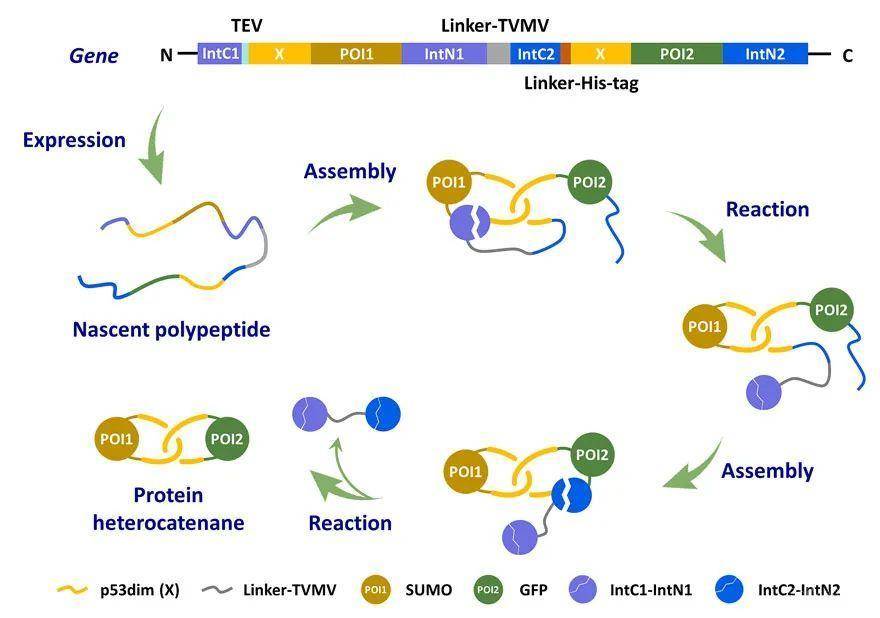
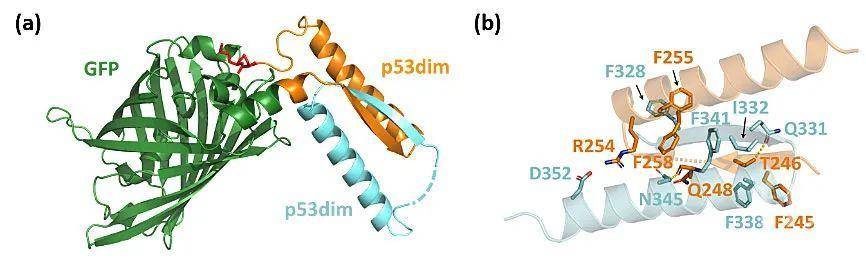
受限于核糖体的线性模板合成机制,化学拓扑在蛋白质工程中一直是相对被忽视的话题。随着研究的不断深入,人们发现了越来越多具有非线性结构的天然拓扑蛋白质。它们通常具有与其拓扑结构相对应的功能优势,在生命活动中行使着重要的角色,发挥着不可或缺的作用。这引起业内对蛋白质拓扑结构调控的广泛兴趣。近年来,发展拓扑蛋白质的制备方法,并探究其结构性能关系和相关应用,已经成为蛋白质工程的热门方向。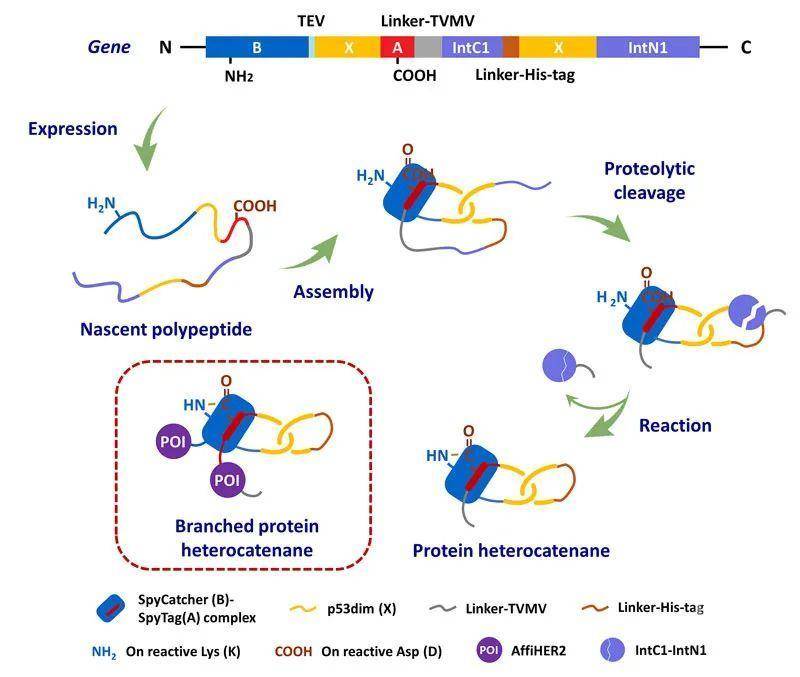
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657642189&idx=3&sn=88b31d16a200d4ffa97f98e198c3465c&chksm=80f84f1db78fc60b9a080cc61e858528058d23f8449c17c576bf4ca64948bc2c88a88ef16732&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
萤石晶体结构

面向空间信息网络的多特征可视化方法综述
王志珍会长致2015年国际蛋白质学会“青年科学家奖”获奖者颜宁的贺信
AI可生成在天然蛋白质中从未见过的拓扑结构
氯化铯晶体结构

【CCHI 2018】陈霖院士:三十年改写认知科学权威理论

能设计新蛋白质的AI再现突破,生成在天然蛋白质中从未见过的拓扑结构

用突变基因,解码蛋白质结构
衍生晶体结构

【复材资讯】科学家首次合成具有拓扑性质石墨烯纳米带