科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-16
来源:BioArt
哺乳动物宿主和对其有益的共生微生物的共同进化导致了宿主-微生物关系的发展【1】。表观遗传修饰使得哺乳动物细胞能够整合外界环境信号,促进细胞对环境的适应性。但是一直以来共生的肠道微生物来源的多种信号通路和多种环境信号是如何精密调控的还不甚清楚。
肠道上皮细胞位于微生物群和宿主之间的界面,促进关键屏障的形成,在健康时期和损伤时期对肠道上皮进行补充【2】。维持肠道上皮细胞分化过程中有多种表观遗传机制参与其中,其中HDACs的表达对于肠道稳态非常关键【3】。肠道微生物来源的短链脂肪酸丁酸盐(Butyrate)在体外抑制HDAC活性,丁酸盐处理后的肠道组织上皮细胞中HDAC活性下降。在无菌鼠中植入产丁酸盐的肠道微生物会抑制肠道上皮细胞中HDAC的活性。这些结果都说明肠道微生物来源的丁酸盐抑制HDAC的活性。但是肠道微生物与组蛋白脱乙酰化酶活性之间的调控机制是怎样的还不得而知。
近日,美国辛辛那提儿童医院医疗中心Theresa Alenghat研究组在Nature杂志上发表文章 Microbiota-derived metabolite promotes HDAC3 activity in the gut,发现肠道微生物来源的肌醇磷酸盐能够调节肠道内组蛋白脱乙酰化酶HDAC3的活性从而促进肠道上皮细胞的修复,揭开了宿主对于肠道微生物信号响应的具体机制。

为了揭开肠道微生物衍生代谢产物与表观遗传信号之间的关系,作者们对野生型以及肠道上皮细胞HDAC3敲除小鼠中的HDAC活性进性检测,发现野生型对照组小鼠中的HDAC3表达正常并且具有稳定的酶活性,但是肠道上皮细胞HDAC3敲除小鼠则相反。作者们想知道HDAC3是否会特异性调节肠道微生物敏感的信号诱导。作者们发现HDAC1与HDAC2在肠道上皮细胞中也有表达,但并不能补偿肠道上皮细胞中HDAC3表达的缺失。而且在对无菌鼠和肠道上皮细胞HDAC3敲除小鼠中的肠道上皮细胞施用HDAC广谱抑制剂处理后,发现在HDAC3敲除后其他种类的HDACs仍然具有活性。这些结果说明肠道微生物促进上皮细胞中HDAC3在正常肠道稳态中的酶活性。
为了破译肠道微生物激活HDAC3的具体机制,作者们对无菌鼠和正常培养的小鼠中肠道上皮细胞中的转录谱进行解析。作者们发现在肠道微生物存在的上皮细胞中与肌醇磷酸代谢相关的基因被广泛诱导表达。前人的研究发现肌醇三磷酸(Inositol trisphosphate)会通过强化HDAC3与激活蛋白的相互作用来增加HDAC3的活性【4】。作者们发现外加肌醇三磷酸的确会特异性增加HDAC3-NcoR重组蛋白的活性,NcoR蛋白对于HDAC3的脱乙酰化酶活性非常关键。
进一步地,作者们想知道无菌鼠与对照组的小鼠肠道之间肌醇三磷酸水平是否存在差异。作者们发现对照组小鼠中无论是肠腔还是肠道上皮细胞中肌醇三磷酸的水平都显著高于无菌鼠,说明肠道微生物的存在促进肌醇三磷酸水平的增加。为了评估肌醇三磷酸对于肠道上皮细胞中HDAC3活性的影响,作者们对肠道上皮细胞中的HDAC3蛋白进行纯化并与肌醇三磷酸进行共同孵育,发现肌醇三磷酸的确能够增加内源HDAC3的活性。而且丁酸酯造成的HDAC3活性的抑制也可以被肌醇三磷酸所拮抗。另外,作者们还发现共生的肠道微生物会通过肌醇六磷酸(Phytate)代谢途径促进肠道上皮细胞中的HDAC3的功能。与肌醇三磷酸相似,肌醇六磷酸也会诱导肠道上皮细胞中的HDAC3的活性。
为了检测肠道微生物肌醇六磷酸依赖的代谢对于HDAC活性的影响,作者们对定植野生型以及肌醇六磷酸酶缺失型大肠杆菌的小鼠进行分析。作者们发现定植肌醇六磷酸酶正常表达大肠杆菌的小鼠相较于无菌鼠以及肌醇六磷酸缺失型大肠杆菌小鼠的肌醇三磷酸水平升高。对小鼠进行右旋糖酐硫酸酯钠(Dextran sodium sulfate, DSS)处理后,会诱导小鼠产生肠道疾病。为了检测肌醇三磷酸在DSS处理诱导的肠道疾病中的作用,作者们对无菌鼠施用肌醇三磷酸后发现肌醇三磷酸能够促进肠道从疾病中恢复并增加无菌鼠的寿命。DSS诱导的结肠炎类似于病人中溃疡性结肠炎。为了进一步确认肠道微生物代谢产物的功能,作者们对人类整合微生物组学计划(Integrative Human Microbiome Project)【5】中的健康样本以及溃疡性结肠炎患者的样品进行检测,发现在溃疡性结肠炎病人肠道中肌醇六磷酸酶的丰度远低于健康样本之中,说明肌醇六磷酸对于肠道损伤修复是必须的。
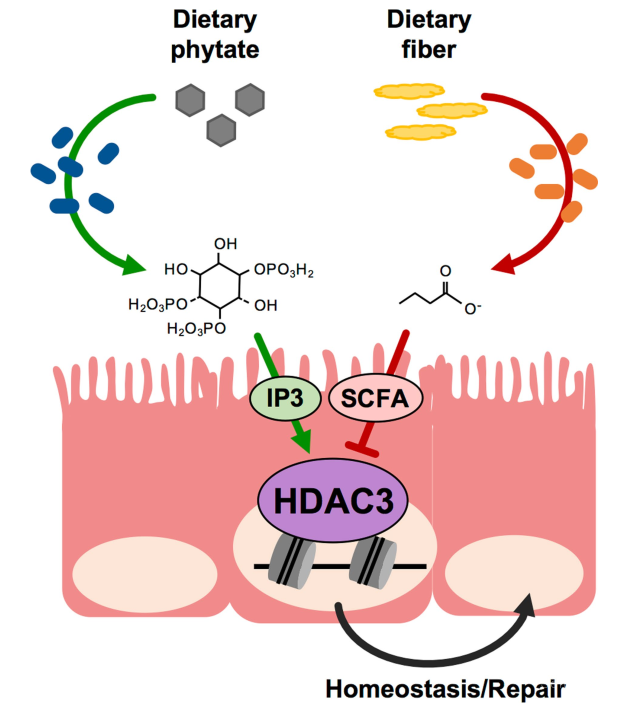
图1 工作模型
总的来说,Alenghat研究组的工作发现相较于无菌鼠,肠道微生物存在的小鼠中HDAC3活性显著提高,这一提高是通过共生的肠道微生物比如大肠杆菌肌醇六磷酸以及肌醇三磷酸的代谢形成的。另外,肌醇三磷酸会诱导病人来源的肠道类器官的生长、刺激HDAC3依赖的细胞增殖以及拮抗丁酸酯引起的肠道生长抑制,会促进肠道疾病中上皮细胞的修复。因此,作者们鉴定发现了HDAC3作为宿主响应多种肠道微生物信号的汇聚表观遗传因子的重要功能,揭开了肠道微生物、表观遗传因子以及微生物代谢产物在肠道上皮以及肠道疾病中的重要调控和修复作用(图1)。
原文链接:https://doi.org/10.1038/s41586-020-2604-2参考文献
1. Honda, K. & Littman, D. R. The microbiome in infectious disease and inflammation. Annual review of immunology 30, 759-795, doi:10.1146/annurev-immunol-020711-074937 (2012).
2. Peterson, L. W. & Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature reviews. Immunology 14, 141-153, doi:10.1038/nri3608 (2014).
3. Alenghat, T. et al. Histone deacetylase 3 coordinates commensal-bacteria-dependent intestinal homeostasis. Nature 504, 153-157, doi:10.1038/nature12687 (2013).
4. Watson, P. J., Fairall, L., Santos, G. M. & Schwabe, J. W. Structure of HDAC3 bound to co-repressor and inositol tetraphosphate. Nature 481, 335-340, doi:10.1038/nature10728 (2012).
5. Lloyd-Price, J. et al. Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases. Nature 569, 655-662, doi:10.1038/s41586-019-1237-9 (2019).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652496053&idx=1&sn=38508de598f4276d4550922db62d4f50&chksm=84e27301b395fa17c7a966b3e6ec30e1b336f04867bed3d10abc6a073450509e4e8d38696c0c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
微生物所开发厌氧菌表达系统挖掘人体微生物天然产物
微生物所建成小鼠肠道微生物资源库
空气微生物检测
微生物培养技术
微生物学: 生命早期的抗生素使用可能会影响发育

成都生物所亚高山森林恢复土壤微生物及酶活性研究获进展

日本科研人员发现无呼吸微生物
叶面微生物
微生物失踪
微生物所发表中国微生物组数据平台