科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-02
来源:BioArt
“代谢重编程”是恶性肿瘤的重要特征。有别于正常的成熟细胞主要以氧化磷酸化的方式来获得能量,恶性肿瘤细胞更倾向吸收更多葡萄糖,通过有氧糖酵解方式 (Warburg效应) 来产生细胞生存的能量和物质。这种看似低效的代谢方式赋予肿瘤细胞更强的增殖和耐药能力。
恶性肿瘤作为一个复杂的类器官结构,其代谢具有明显的时空特性。例如,不同肿瘤部位的糖代谢具有显著特点:肿瘤中心容易出现缺氧区域,缺氧环境往往激活HIF-1α促使肿瘤细胞发生糖酵解。然而,即使在肿瘤浸润前沿的非乏氧区域,肿瘤细胞仍然有显著的HIF-1α激活,并促进肿瘤细胞有氧糖酵解。既往对该现象的机制研究主要集中在肿瘤细胞本身的信号通路上 【1,2】,但对局部微环境中不同类型细胞间的代谢信息交流关注较少。
中山大学孙逸仙纪念医院宋尔卫/苏士成合作组【3-6】及其他团队【7,8】既往发现巨噬细胞是肿瘤微环境中数目最多的白细胞,肿瘤相关巨噬细胞对肿瘤的发生发展起着关键的调控作用。巨噬细胞和肿瘤细胞互相影响对方的代谢状态。例如,该团队既往发现肿瘤细胞产生的乳酸,能诱导巨噬细胞向促肿瘤表型分化,通过CCL18促进转移,提示免疫代谢产物(immunometabolite)能作为信号分子调控免疫细胞的命运分化 【9】。但是,是否存在新型分子作为免疫-肿瘤细胞间代谢交流信号目前仍不清楚。
2019年4月1日,宋尔卫/苏士成合作组在 Nature Cell Biology 杂志在线发表了题为Extracellular Vesicle-packaged HIF-1α-stabilizing LncRNA from Tumour-associated Macrophages Regulates Aerobic Glycolysis of Breast Cancer Cells 的研究论文。该研究揭示巨噬细胞分泌外泌体所包裹的lncRNA,可作为细胞间信号传导分子调控肿瘤细胞的代谢重编程。

该研究首先通过乳腺癌组织连续切片免疫组化染色发现,不仅在肿瘤中心的缺氧地带肿瘤细胞具有显著的有氧糖酵解现象,即使是在肿瘤的边缘氧供充分的位置,肿瘤细胞仍可能表现出显著的有氧糖酵解状态,而糖酵解的存在与肿瘤细胞的凋亡水平呈显著负相关。而更为有趣的是,在肿瘤边缘有氧糖酵解显著的肿瘤细胞周围往往伴随着大量巨噬细胞的浸润,提示肿瘤间质中的巨噬细胞与恶性肿瘤细胞常氧状态下的有氧糖酵解存在明显的相关性。进一步体外实验显示,从乳腺癌组织中分离得到的巨噬细胞在与乳腺癌细胞共培养后确实能够显著提高乳腺癌细胞的有氧糖酵解水平并增强乳腺癌细胞抵抗化疗药物杀伤及失巢凋亡的能力。
机制研究发现:肿瘤相关巨噬细胞对乳腺癌细胞有氧糖酵解的促进作用并非由巨噬细胞所分泌的可溶性细胞因子所引起,是由巨噬细胞分泌的外泌体来介导的。巨噬细胞来源的外泌体包裹着巨噬细胞所特有的长非编码RNA HISLA (HIF-1α Stabilizing Long Noncoding RNA) 被肿瘤细胞摄取后可以把HISLA释放入肿瘤细胞中,通过抑制调控有氧糖酵解的关键转录因子HIF-1a与其羟化酶PHD2的结合来抑制HIF-1a的降解,从而维持肿瘤细胞有氧状态在HIF-1a信号的持续激活(下图)。反过来,处于显著有氧糖酵解状态的肿瘤细胞可分泌大量的乳酸分子,乳酸作用于巨噬细胞可显著上调巨噬细胞中HISLA的表达,从而维持巨噬细胞来源的外泌体中HISLA的高丰度装载。
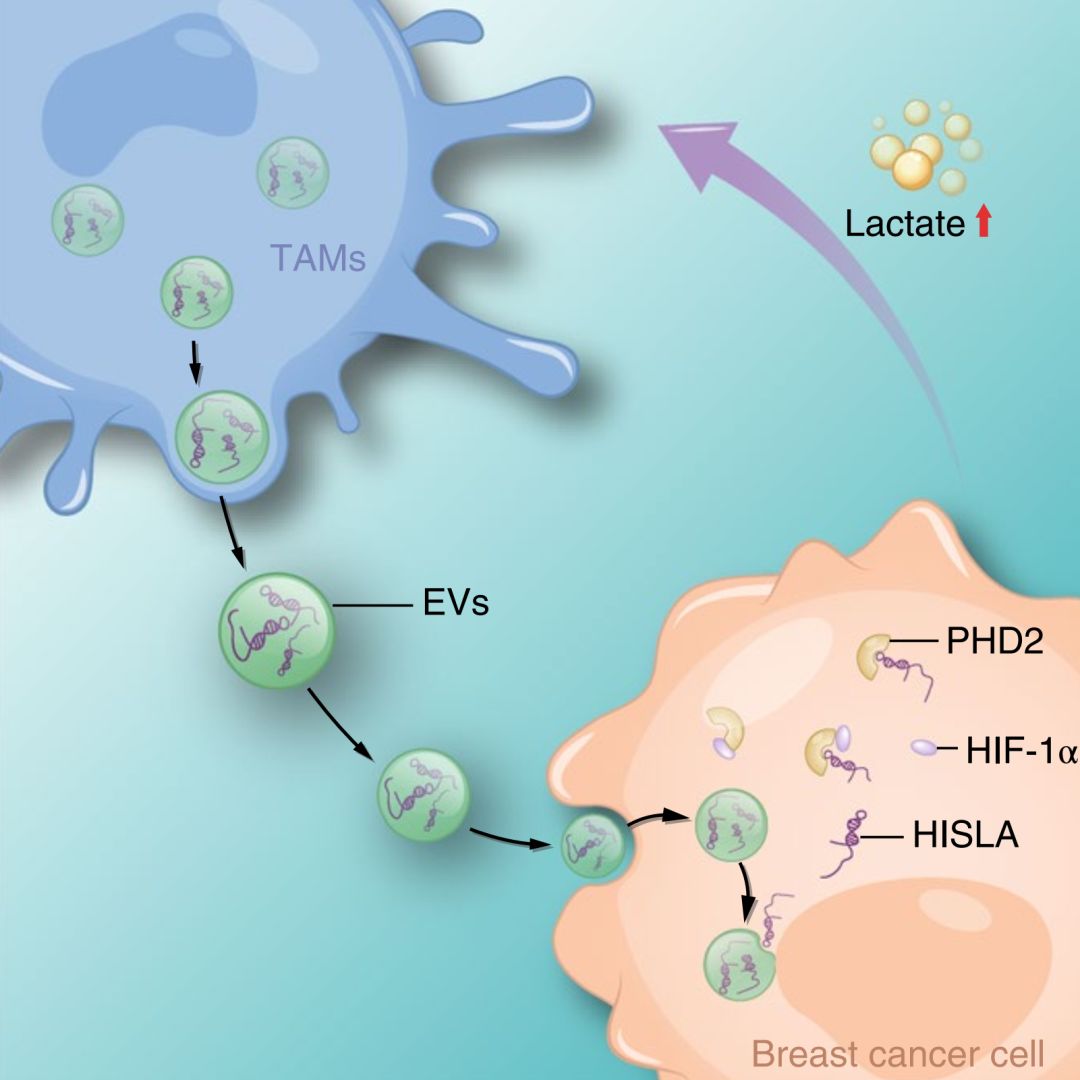
机制示意图
该研究阐明了巨噬细胞与肿瘤细胞间由外泌体所包裹的长非编码RNA及代谢产物所介导的正反馈代谢调控环路,为针对肿瘤微环境靶向恶性肿瘤代谢重编程的免疫治疗提供了新思路。
据悉,宋尔卫教授、苏士成副主任医师是本论文的共同通讯作者,陈嘉宁和杨林槟为本文的共同第一作者。中山大学是唯一作者单位。
原文链接:
https://doi.org/10.1038/s41556-019-0299-0
制版人:珂
参考文献
1. Lin, A., Li, C., Xing, Z., Hu, Q., Liang, K., Han, L., Wang, C., Hawke, D.H., Wang, S., Zhang, Y., et al. (2016). The LINK-A lncRNA activates normoxic HIF1alpha signalling in triple-negative breast cancer. Nat Cell Biol 18, 213-224.
2. Liu, J., Zhang, C., Zhao, Y., Yue, X., Wu, H., Huang, S., Chen, J., Tomsky, K., Xie, H., Khella, C.A., et al. (2017). Parkin targets HIF-1alpha for ubiquitination and degradation to inhibit breast tumor progression. Nat Commun 8, 1823.
3. Huang, D., Song, S.J., Wu, Z.Z., Wu, W., Cui, X.Y., Chen, J.N., Zeng, M.S., and Su, S.C. (2017). Epstein-Barr Virus-Induced VEGF and GM-CSF Drive Nasopharyngeal Carcinoma Metastasis via Recruitment and Activation of Macrophages. Cancer Res 77, 3591-3604.
4. Su, S., Chen, J., Yao, H., Liu, J., Yu, S., Lao, L., Wang, M., Luo, M., Xing, Y., Chen, F., et al. (2018a). CD10(+)GPR77(+) Cancer-Associated Fibroblasts Promote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness. Cell 172, 841-856 e816.
5. Su, S., Liao, J., Liu, J., Huang, D., He, C., Chen, F., Yang, L., Wu, W., Chen, J., Lin, L., et al. (2017). Blocking the recruitment of naive CD4+ T cells reverses immunosuppression in breast cancer. Cell Res 27, 461-482.
6. Su, S., Zhao, J., Xing, Y., Zhang, X., Liu, J., Ouyang, Q., Chen, J., Su, F., Liu, Q., and Song, E. (2018b). Immune Checkpoint Inhibition Overcomes ADCP-Induced Immunosuppression by Macrophages. Cell 175, 442-457 e423.
7. Qian, B.Z., and Pollard, J.W. (2010). Macrophage diversity enhances tumor progression and metastasis. Cell 141, 39-51.
8. Zhao, Q., Kuang, D.M., Wu, Y., Xiao, X., Li, X.F., Li, T.J., and Zheng, L. (2012). Activated CD69+ T cells foster immune privilege by regulating IDO expression in tumor-associated macrophages. J Immunol 188, 1117-1124.
9. Su, S., Liu, Q., Chen, J., Chen, J., Chen, F., He, C., Huang, D., Wu, W., Lin, L., Huang, W., et al. (2014). A positive feedback loop between mesenchymal-like cancer cells and macrophages is essential to breast cancer metastasis. Cancer Cell 25, 605-620.

来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468249&idx=1&sn=3576c72b0864f23b4d7d736cf4811686&chksm=84e2e7adb3956ebb267a172e6e45c93d0980b77f2b8c1f4b67754f9b42ce63f1d1f126bc654e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

北京基因组所等揭示肿瘤相关巨噬细胞调控CD8+T细胞命运新机制
Cell Metabolism丨膜胆固醇外排驱动肿瘤相关巨噬细胞重编程和肿瘤发展

CD103阳性的肿瘤干细胞外泌体促进肾透明细胞癌的EMT进程和肿瘤转移

陈佩文博士等发现巨噬细胞与肿瘤细胞的互惠共生作用揭示新的抗肿瘤靶点
中国科大在肿瘤细胞调控糖酵解和线粒体呼吸代谢平衡机制方面取得新成果
尹航组通过靶向葡萄糖转运蛋白调控肿瘤细胞的有氧糖酵解
Nature 子刊:揭秘肿瘤新克星,巨噬细胞活化通路大解析
Nature子刊:对抗实体肿瘤,研究者发现CAR巨噬细胞新疗法!

NCB :肿瘤外泌体蛋白促进癌细胞脑转移

Radiology:高级别胶质瘤肿瘤细胞中有多少巨噬细胞在躁动?