科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-06
来源:ScienceAAAS
中科院青促会 张杰
(中科院微生物研究所)
评述论文:Ligand-triggered allosteric ADP release primes a plant NLR complex (Science 5 April 2019: Vol 364, Issue 6435)
Reconstitution and structure of a plant NLR resistosome conferring immunity (Science 5 April 2019: Vol 364, Issue 6435)
植物在自然界中时刻面临各种病原微生物的侵染,为了抵抗病原微生物入侵,在与其漫长的相互作用过程中形成了多层次的免疫系统。微生物表面保守的分子模式(Pathogen-associated molecular patterns,PAMPs)被植物细胞膜上的模式识别受体(Pattern-recognition receptors,PRRs)识别,激活广谱的免疫反应(PAMP-triggered immunity,PTI);病原微生物通过分泌效应蛋白(Effectors)进入植物细胞抑制PTI并促进致病性;而其中的一部分效应蛋白又被植物细胞内的免疫受体(Nucleotide-binding domain (NBD) and leucine-rich repeat (LRR) receptors, NLRs)识别,激活特异性的免疫反应(Effector-triggered immunity,ETI)。植物NLR蛋白对效应蛋白的识别,是决定病原微生物宿主范围的重要因素。
NLR蛋白是一大类广泛存在于植物和动物中的细胞内免疫受体,通常包含有N端的可变结构域,中间的核苷酸结合构域 (Nucleotide-binding domain, NBD)和C端的亮氨酸重复结构域 (Leucine-rich repeats, LRRs)[1, 2]。一些动物NLR蛋白在静息状态下结合ADP,通过LRR结构域与其NBD结构域的相互作用限制NLR蛋白形成寡聚体,使其处于自抑制状态。感受PAMPs后,NLR蛋白发生构象改变,结合ATP并寡聚形成复合体,通过其N端招募接头蛋白以及半胱天冬蛋白酶(Caspase)等组装成蛋白复合物--炎症小体(Inflammasome ),促进许多促炎性细胞因子分泌,同时启动细胞焦亡以清理病原微生物和受损细胞,是动物固有免疫的重要组分[3, 4, 5]。
植物NLR蛋白成员相较于动物有显著扩增。二十多年来的研究表明,为数众多的植物NLR蛋白感受病原微生物特异的Effector,而不是PAMPs,激活免疫反应ETI,并通常伴随有植物细胞死亡[6]。根据N端结构域的不同,植物NLR蛋白分为CC(Coiled-coil domain)-NLRs和TIR(TOLL/interleukin 1 receptor-like domain)-NLRs[2]。然而目前为止还没有任何一个完整的植物NLR蛋白结构被报道,植物NLR蛋白维持自抑制和激活的生化机制,以及激活后诱导细胞坏死的分子机制是植物免疫研究领域关注度极高的重要科学问题。
本期Science杂志发表的两篇来自中国清华大学和中国科学院遗传与发育生物学研究所合作研究的论文(Wang et al., Science 2019: 364, eaav5868; Wang et al., Science 2019: 364, eaav5870)报道了首个植物全长CC-NLR蛋白ZAR1(HOPZ-ACTIVATED RESISTANCE 1)复合体自抑制、中间态以及激活态的结构。静息状态下,植物ZAR1蛋白与假激酶RKS1形成蛋白复合体。植物病原细菌--黄单胞菌入侵植物时,其效应蛋白AvrAC通过尿苷酰化修饰植物激酶PBL2(PBL2UMP)[7]。Wang et al., Science 2019: 364, eaav5868论文通过解析ZAR1-RKS1二元复合体以及ZAR1-RKS1-PBL2UMP三元复合体的结构,发现被修饰后的PBL2UMP与RKS1结合,诱导ZAR1的NBD结构域构象改变和ADP释放,形成ZAR1蛋白复合体的中间态,揭示了ZAR1蛋白维持自抑制的分子机制(图1)。然而中间态复合体中ZAR1构象仍类似于未激活状态,因此作者推测ZAR1激活还需要有新的信号。基于此,Wang et al., Science 2019: 364, eaav5870论文发现dATP诱导ZAR1-RKS1-PBL2UMP体外寡聚形成五聚复合体--抗病小体(Resistosome)。通过解析抗病小体的结构,证明了植物NLR蛋白与动物NLR蛋白类似的寡聚激活机制。然而,与动物NLR蛋白不同,ZAR1寡聚体中其N端大部分被包埋形成漏斗状,只暴露出极短的α螺旋,介导ZAR1的植物细胞膜定位和免疫活性(图1),提示了不同于动物NLR蛋白激活下游信号的机制。
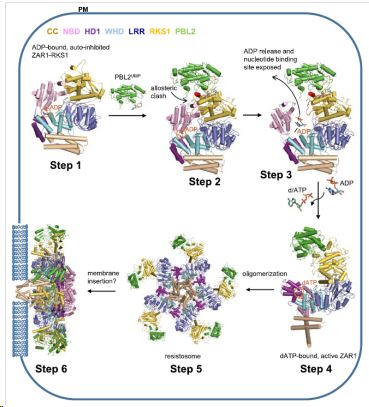
图1. ZAR1抗病小体的组装和激活过程
该两项研究解析了植物中首个全长NLR蛋白复合体自抑制、中间态以及激活态的结构,揭示了植物NLR蛋白维持自抑制和形成五聚体激活的生物化学机制。首次提出了植物免疫系统抗病小体的概念,提示了植物NLR蛋白结合或整合到植物细胞膜,直接调控其完整性或离子平衡从而介导细胞坏死的分子机制。该研究成果是植物免疫研究领域重要的里程碑式进展,对未来高效和合理利用NLR改良植物抗病性具有重要指导意义。
述评人简介张杰博士,中科院微生物研究所研究组长,中科院青年创新促进会优秀会员。主要从事微生物致病机理和植物免疫机制研究。
参考文献:
1. J. D. Jones, J. L. Dangl, The plant immune system. Nature 444, 323–329 (2006).
2. T. Maekawa, T. A. Kufer, P. Schulze-Lefert, NLR functions in plant and animal immune systems: So far and yet so close. Nat. Immunol. 12, 817–826 (2011).
3. Q. Yin, T. M. Fu, J. Li, H. Wu, Structural biology of innate immunity. Annu. Rev. Immunol. 33, 393–416 (2015).
4. Z. Hu et al., Structural and biochemical basis for induced self-propagation of NLRC4. Science 350, 399–404 (2015).
5. T. F. Reubold, S. Wohlgemuth, S. Eschenburg, Crystal structure of full-length Apaf-1: How the death signal is relayed in the mitochondrial pathway of apoptosis. Structure 19, 1074–1083 (2011).
6. H. Cui, K. Tsuda, J. E. Parker, Effector-triggered immunity: From pathogen perception to robust defense. Annu. Rev. Plant Biol. 66, 487–511 (2015).
7. G. Wang et al., The decoy substrate of a pathogen effector and a pseudokinase specify pathogen-induced modified-self recognition and immunity in plants. Cell Host Microbe 18, 285–295 (2015).
来源:Science-AAAS ScienceAAAS
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDY3NzQ2Mg==&mid=2247486744&idx=3&sn=7df973dbca973d1c7597c8f42940070e&chksm=eb1126a1dc66afb7526453dd53b84f12f3b1f199941bd47578de61989cb70fa890135ec7d2f3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

昆明植物所发现植物开花调控机制
阴性植物
植物细胞
植物所揭示植物免疫反应调控新途径

植物所在植物物种形成研究中获进展
植物大家族——竹类植物
植物所等发现植物免疫信号新组分
中国植物生理与植物分子生物学学会植物生物学女科学家分会第三届学术交流会成功举办
植物散发
粪便植物细胞与植物纤维