科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-11
来源:brainnews
编者按:2017年是英国医生詹姆斯·帕金森第一次发表帕金森病(PD)症状描述的200周年。虽然很久以来,医生们能够诊断这种疾病,但是PD疗法的第一个突破出现在上世纪60年代,左旋多巴(levodopa)在PD患者中第一次表现出临床疗效。自从左旋多巴问世以来,它一直是控制PD症状的主要疗法。左旋多巴的作用是弥补PD患者中多巴胺信号通路的缺陷,但是这种疗法的疗效随着疾病的加重逐渐减弱,而且会带来各种副作用。在过去十年里,研究人员开始发掘PD的其它疗法。近日《Nature Reviews Drug Discovery》期刊上发表的一篇综述对这些治疗PD的新策略进行了盘点。在今天的这篇文章中,药明康德微信团队将跟各位读者分享这些治疗PD的新策略。

▲帕金森病的疾病研究和医疗发展历史(图片来源:参考资料[1])
PD疾病发生机理
PD是一种与年龄相关的神经退行性疾病,患者大脑黑质(substantia nigra)中的多巴胺神经细胞随着时间的推移逐渐死亡。这导致了PD最经典的症状:静止性震颤和肢体僵硬。除了多巴胺系统功能下降以外,PD患者在其它类型的神经通路中也出现异常,这些神经通路包括胆碱,血清素,谷氨酸和去甲肾上腺素通路。PD的疾病发生机制非常复杂,导致神经元死亡的分子机制还没有被完全澄清,但是科学研究已经帮助发现了与PD病理学相关的多条通路。其中主要的致病因素包括:
α-突触核蛋白聚集:α-突触核蛋白在体内以多种构象存在,它们之间的动态平衡受到包括氧化应激,转译后蛋白修饰,脂肪酸、磷脂和金属离子浓度等因素的调控。这些因子之间的平衡控制着α-突触核蛋白的水平和聚集程度。当α-突触核蛋白从可溶单体相互结合变为不可溶的淀粉样沉积时,它们会产生神经毒性。有研究表明折叠错误的α-突触核蛋白能够像朊病毒一样在不同细胞之间传播,并且在新的细胞里可以导致内源α-突触核蛋白发生聚集。因此,在很少数量细胞中α-突触核蛋白的错误折叠可能逐渐传播到其它大脑区域。
线粒体功能失常:线粒体呼吸链中复合物1的功能失常会导致膜电位变化,扰乱钙离子的平衡和细胞色素C的释放。
氧化应激:与线粒体功能失常密切相关,黑质中的多巴胺神经元对氧化应激尤其敏感。线粒体功能失常和氧化应激水平提高会导致溶酶体自噬系统的缺陷。这表明导致PD的不同病理途径之间可能有紧密的联系。
自噬功能失常:这可能提高α-突触核蛋白的释放和在细胞之间的传播。
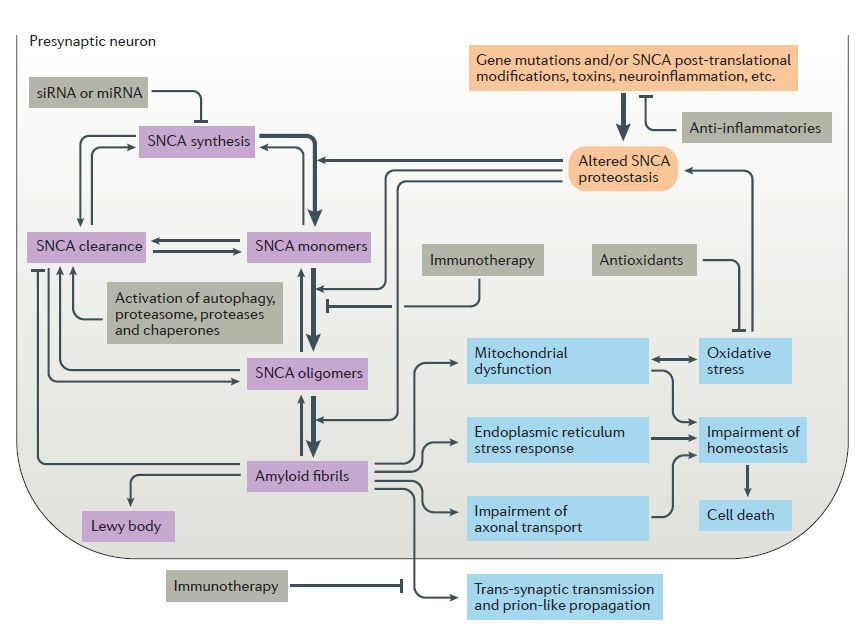
▲帕金森病的病理机制和与之相关的医疗策略(图片来源:参考资料[1])
基于对PD疾病发生机制的进一步理解,研究人员已经发现了多个创新靶点,并且开发出新的在研疗法。在过去十年里,科学研究发现了与PD风险相关的24个基因位点,靶向与这些位点相关的蛋白的在研药物也已经进入早期研发阶段。下面我们来看一看这些创新疗法:
基因疗法
治疗PD的新兴疗法之一是使用基因疗法将多巴胺代谢过程中的关键性蛋白直接运送到基底核中。例如,ProSavin(OXB-101)是一种能将多巴胺合成过程中需要的三种关键酶运送到大脑中的病毒载体。在一项小规模的1/2期开放标签临床试验中,ProSavin被注射到15名PD患者的壳核(putamen)中。试验结果表明患者的运功能力在接受治疗后6-12月时出现剂量依赖性提高。目前,研究人员已经开发出新一代病毒载体(OXB-102),它能够更好的表达运送的基因。预计将在2018年底启动一项1/2期剂量递增研究来检验它治疗晚期PD患者的疗效。
另一种基因疗法旨在恢复多巴胺神经元中多巴脱羧酶(AADC)的水平。使用名为VY-AADC的病毒载体,这一基因疗法希望在多巴胺神经元中持续表达AADC,从而长久地增强从多巴向多巴胺的转换。目前,在15名晚期PD患者中进行的1b期临床试验正在进行中。在2017年发表的中期结果表明,这一疗法能够持久地,剂量依赖性地提高AADC的活性,同时产生相对应的运动能力改善。美国FDA已经批准了IND申请,而且为VY-AADC的关键性2/3期临床项目授予了再生医学先进疗法(RMAT)资格。这项临床研究预计在2020年末或2021年初完成。
目前的基因疗法需要开颅手术将病毒载体注射到患者大脑中,这意味着对于早期PD患者来说,这些手段并不适用。改善基因疗法的施药方法,减少它们的侵入性,是治疗PD的基因疗法研发的重要方向。
α-突触核蛋白靶向疗法
所有PD患者中都会出现有毒的α-突触核蛋白聚集,目前有三种策略来对抗α-突触核蛋白引发的细胞毒性:通过免疫疗法阻断α-突触核蛋白的扩散;抑制α-突触核蛋白的聚集;促进α-突触核蛋白的清除,这可以通过抑制它的生成或促进它的分解来完成。
在过去十年中,多个研究团队已经开发出针对α-突触核蛋白的抗体或者α-突触核蛋白疫苗来作为改变疾病进程的疗法。其中,名为PRX002的α-突触核蛋白单克隆抗体的安全性已经在1期临床试验中得到证明。这项研究同时表明PRX002能够进入中枢神经系统,并且可以降低血清中的α-突触核蛋白水平。罗氏(Roche)在2017年7月启动了一项随机双盲,含安慰剂对照的2期临床试验,在早期PD患者中检验每月静脉注射PRX002的疗效。该试验的主要终点为与基线相比运动能力的变化。
Affiris公司开发了两种模拟α-突触核蛋白的多肽疫苗(Affitopes PD01A和PD03A)。在小鼠模型中,这些疫苗能够降低神经元轴突和神经突触中的α-突触核蛋白寡聚体水平,而且减少多巴胺神经元的死亡。在2017年6月公布的1期临床研究的顶线结果表明,Affitope PD03A在早期PD患者中表现出良好的安全性和耐受性,并且能够剂量依赖性激发宿主的免疫反应。今年8月,长期数据表明在第36周进行的增强注射能够重新激活患者的免疫反应。这些数据鼓励人们继续进行临床研发。
不过使用免疫疗法治疗PD仍然需要解决几个挑战,其中之一是足够水平的抗体能否到达指定脑区,并且对靶点蛋白产生预期的作用。未来几年里对这些蛋白在患者身上作用的研究将帮助回答这个问题。
除了免疫疗法以外,另外一种策略是阻止或降低α-突触核蛋白的聚集。例如名为anle138b的化合物能够与α-突触核蛋白的特定结构位点相结合,在体外和体内抑制致病的α-突触核蛋白寡聚体的产生。目前这一化合物的功能只在动物模型中得到了验证。另一个名为NPT200-11的化合物通过阻断α-突触核蛋白与细胞膜的互动来降低寡聚体的生成。这款化合物已经完成1期临床试验。这类化合物的潜在优势在于它们是小分子,因此与单克隆抗体相比,更容易到达指定脑区,而且不会有被宿主抗体中和的风险。
其它靶向α-突触核蛋白积累的方法包括使用基因沉默(siRNA)的方法来降低α-突触核蛋白水平。靶向α-突触核蛋白的siRNA在非人灵长类模型中能够将α-突触核蛋白的表达水平降低40%。对于携带多拷贝SNCA基因的患者来说,这种方法可能更为有效。最近靶向RNA的疗法在治疗脊髓性肌萎缩症(SMA)和遗传性转甲状腺素介导的淀粉样变性(hATTR)方面取得的成功也唤起了人们使用它治疗PD的希望。
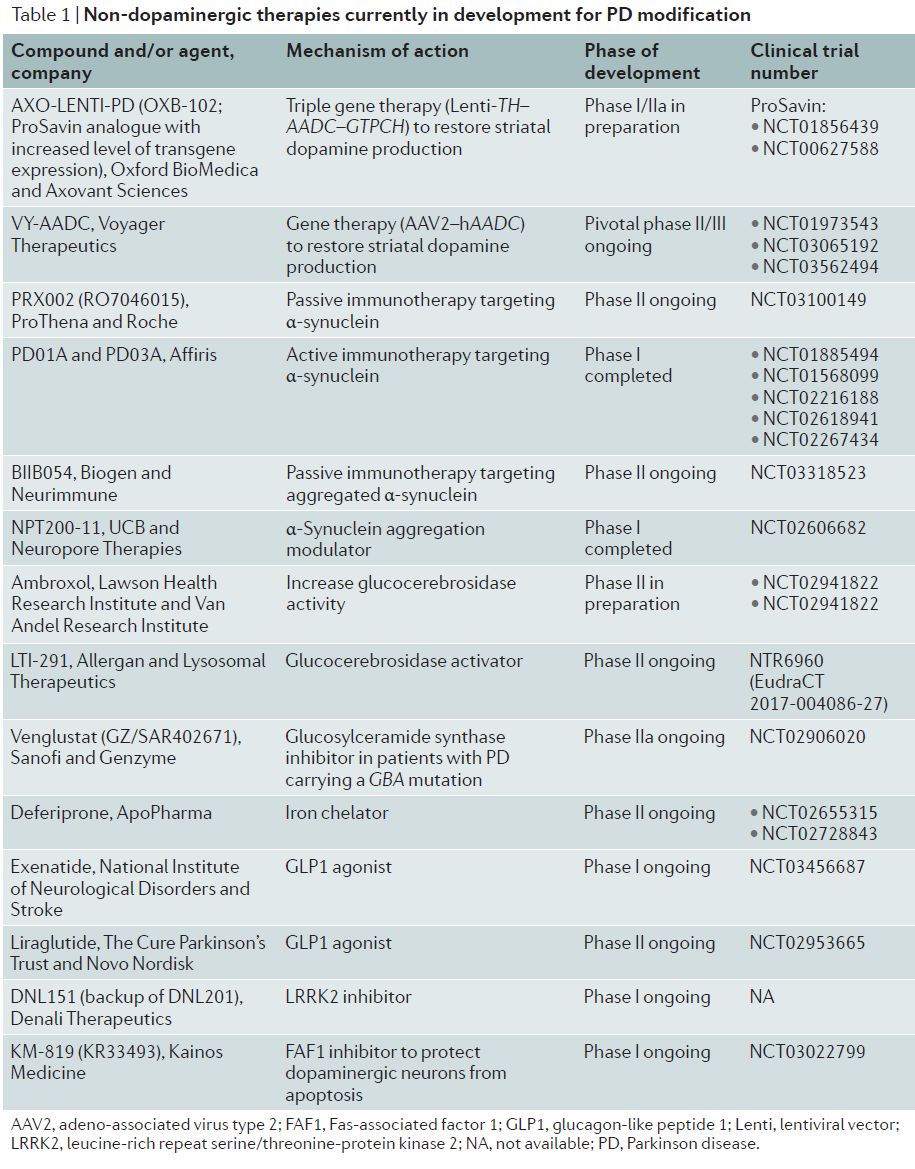
▲改变PD疾病进程的新治疗策略(图片来源:参考资料[1])
谷胱甘肽替代疗法
还原态的谷胱甘肽与清除活性氧和细胞排毒过程相关,而且它的水平在早期PD患者中下降。因此,恢复PD患者体内的谷胱甘肽水平也是治疗PD的一个研究方向。但是谷胱甘肽替代疗法的挑战是这种多肽在血浆中的半衰期只有2.5分钟,这意味着很难将足够水平的谷胱甘肽送入大脑。在有些研究中,使用鼻腔吸入的给药方法可能成为将谷胱甘肽送入大脑的有效方法。但是目前无法确认目前形式的谷胱甘肽能够在大脑中达到足够的浓度,并且停留足够长的时间来产生疗效。这是这一疗法需要解决的最大挑战。
溶酶体途径和GBA激活剂
目前的统计表明大约5-10%的PD患者在GBA基因上携带基因突变,这导致溶酶体蛋白酶的缺失。有趣的是,增强GBA活性会通过清除糖脂的水平调节或降低α-突触核蛋白的错误折叠。这一互动关系支持用增强GBA活性的方法来治疗PD。
目前,多个靶向GBA的2期临床试验正在进行中。Amboxol是一个小分子伴侣,它能够在体外和体内提高GBA活性,并且降低α-突触核蛋白的水平。LTI-291是另一个GBA激动剂,它在荷兰进行的2期临床试验中治疗携带特定GBA基因突变(NTR6960, EudraCT2017‑004086‑27)的PD患者。Venglustat虽然不靶向GBA,但是它是一种葡糖神经酰胺合成酶抑制剂,能够降低糖脂的水平,从而降低α-突触核蛋白的错误折叠。它目前在2期临床试验中治疗携带GBA突变的早期PD患者。这些2期临床试验以及后续研究的结果,对确定溶酶体途径能否带来治疗PD的创新疗法意义重大。
铁螯合剂
在PD患者中,大脑黑质致密部的铁元素水平显著升高,而且铁元素的水平与疾病严重性有正相关关系。虽然在PD大脑中铁的过度积累导致PD疾病发生的机制还没有得到澄清,但是铁螯合剂被认为可能在PD患者中起到保护神经的作用。最近,一种名为deferiprone的可穿过细胞膜的铁螯合剂,在小鼠实验中能够剂量依赖性降低MPTP导致的氧化损伤,并且改善它们的运动功能。随后在一项单中心,双盲,含安慰剂对照的临床试验中,40名早期PD患者接受了deferiprone的治疗。患者同时接受多巴胺药物治疗。试验结果表明,接受deferiprone治疗的患者大脑黑质中铁元素的沉积和运动能力都得到改善。目前deferiprone正在一项包含338名早期PD患者的2期临床试验中接受检验。
值得注意的是,在人体内改变铁元素的新陈代谢可能引发多种副作用,影响造血和其它全身性指标。所以在局部降低铁元素沉积而不影响血液循环中的金属水平的策略更具有吸引力。
GLP1受体激动剂
流行病学和临床数据表明PD和2型糖尿病(T2DM)可能拥有共同的失控信号通路,这意味着它们可能具有共同的病理机制。在T2DM早期,患者出现胰岛素抗性,这导致一系列新陈代谢和炎症方面的不良影响。在PD早期,患者在葡萄糖和能量代谢方面出现类似的失调,大脑中胰岛素信号通路的缺失可能在PD疾病发生中起到重要作用。
Exenatide是一种已经获批的T2DM疗法,它是一种GLP1受体激动剂,具有抗炎症和抗氧化作用。试点试验结果表明exenatide能够在PD患者身上显示出疗效。目前,exenatide正在另一项临床试验中治疗PD患者,检测为期一年的治疗对患者生活质量、抑郁、运动能力、认知能力等指标的影响。此外,一项单中心,双盲,含安慰剂对照的2期临床试验在检测liraglutide在57名PD患者中的疗效,liraglutide是一种人类GLP1的类似物,它具有更长的半衰期,已经被批准用于治疗T2DM。
我们需要更多的大型临床试验来验证靶向GLP1受体能否为PD患者提供持久和有意义的神经保护。
LRRK2抑制剂
在与PD相关的基因中,LRRK2基因被认为是个关键因子。PD患者携带的LRRK2基因上的突变与细胞培养环境中神经元的病理蛋白激酶活性相关,这引起了研发LRRK2激酶抑制剂的兴趣。虽然携带LRKK2基因突变的PD患者只占PD患者总数的一小部分,但是最近研究发现,在从PD患者身上获取的多巴胺神经元和小胶质细胞中,野生型LRKK2蛋白激酶的活性升高。这意味着LRKK2抑制剂可能对不携带LRKK2基因突变的PD患者也能产生疗效。
第一个小分子LRRK2抑制剂DNL201,在2017年进入临床试验,并且在1期试验中在健康志愿者身上表现出抑制LRRK2激酶的活性。另一个LRRK2抑制剂DNL151,目前在健康志愿者中接受检验,以找出最具前景的分子在携带LRRK2基因突变的PD患者中进行检验。
FAF1抑制剂
在PARK2基因中出现的突变与早发性PD相关。而PARK2编码的帕金蛋白(parkin)的正常作用是抑制促凋亡蛋白FAF1的活性。这一发现带来了抑制FAF1这一治疗PD的创新策略。KM-819是一个FAF1的小分子抑制剂,它目前在韩国进入1期临床试验。
结语
我们在寻找和开发治疗PD的新疗法方面已经取得了长足进步,多个候选药物正在进入临床研究,它们具有改变疾病进程的潜力。虽然PD的病理发生机制还没有得到完全澄清,但是随着更好的疾病生物标志物和靶点的发现,开发更好的PD疗法拥有广阔的前景。
在临床前研究方面,我们需要更好地关注新化合物的效力,在多种模型和多项研究中验证新化合物的效力,并且与已知分子进行比较。以往研究表明,在临床前动物实验中只显示出轻微疗效的化合物在2期或3期试验中很可能无法显示出疗效。我们需要现代化和前瞻性科学研究,来推动发现对PD患者更有效的药物实体。
点击文末“阅读原文/Read more”,即可访问原文网页。
本文题图来自123RF。
参考资料:
[1] Charvin et al., (2018). Therapeutic strategies for Parkinson disease: beyond dopaminergic drugs. Nature Reviews Drug Discovery, https://doi.org/10.1038/nrd.2018.136
来源:brainnews brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649566614&idx=1&sn=05aa64e85419a2e67995fd784542db5a&chksm=f2edcb62c59a4274171eecde90004f3d69c0993f13e5be5bd03534a3b7c580eec7b627e56f62&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
健康 临床实验 多巴胺 基因疗法 多巴胺受体 药品 基因合成 帕金森病的症状 谷胱甘肽
研究揭示星形胶质细胞多巴胺受体D2在神经系统自身免疫性疾病中的作用

上海药物所等揭示多巴胺受体D3配体选择性和激活Gi的结构基础

多巴胺受体结构解析,或有利于寻找更安全的抗精神病药物
【科技前沿】徐华强/张岩等合作揭示多巴胺受体D1R与多巴胺结合特性以及潜在变构调节机制
汪胜/程建军团队报道基于结构的多巴胺D2受体选择性配体
Nat Comm :汪胜/程建军合作揭示结构指导设计的多巴胺D2受体选择性配体
晚期转移肺癌的免疫治疗临床实验获得成功!
中科院等科学家合作研究揭示多巴胺受体D1R与多巴胺结合特性及潜在变构调节机制
石远凯的面对面视频
全球首发国产新冠特效药,获批开展临床实验!