科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-10
来源:BioArt
线粒体是绝大多数真核细胞中存在的至关重要的一种细胞器,除了参与细胞能量代谢以外,它的另一个重要功能是吸收并储存大量钙离子从而缓冲细胞质中钙离子浓度的剧烈变化,达到控制细胞内部各部分钙离子浓度稳态的目的。线粒体基质中钙离子浓度失衡会导致线粒体内能量代谢失衡,引发自由氧基团的过量积累,导致线粒体损伤进而诱导细胞发生自噬或凋亡。许多与线粒体相关的人类重大疾病(神经退行性疾病,癌症,糖尿病等)都和线粒体内钙离子稳态紊乱有着紧密联系。为了控制线粒体内钙离子浓度,线粒体对钙离子的吸收是一个需要严格调控的过程,这种调控功能是通过线粒体内膜上的MCU复合物(Mitochondrial Calcium Uniporter Complex)完成的。
在植物和单细胞动物中,MCU复合物由两部分组成:位于线粒体内膜的钙离子(单向)通道MCU和位于线粒体膜间隙的调控亚基MICU1。MICU1封闭MCU的钙离子选择性滤器,阻止钙离子进入线粒体。在内质网释放钙离子时,MICU1感应细胞质中钙离子浓度的升高,结合钙离子并使构象从关闭状态变为开放状态,MCU对钙离子具有选择性透过能力,整个复合物对钙离子变得高度通透,完成线粒体对钙离子的快速吸收。
在多细胞动物中,MCU复合物的组成相对复杂。其跨膜通道由MCU与EMRE(an essential MCU regulator)共同组成并发挥功能——失去EMRE的MCU处于失活状态,这与植物或单细胞动物中MCU独立行使功能不同;除此之外,EMRE还介导跨膜通道与膜间隙调控亚基之间的相互作用。膜间隙的调控亚基部分除了有抑制MCU的MICU1,还有一般认为对MICU1抑制作用进行负调节的MICU2,以及功能尚不清楚的在神经细胞中特异性表达的MICU3。
从2011年MCU被发现【1,2】至今,MCU复合物的核心成员MCU的结构和功能已经在真菌中得到了比较明确的阐释【3-6】。然而,对于多细胞动物为什么需要EMRE来激活MCU的功能,以及EMRE是如何参与复合物的形成进而激活MCU等等科学问题,依然需要更多的实验证据来回答。
2019年5月9日,来自美国得克萨斯大学西南医学中心(University of Texas, Southwestern Medical Center)的姜有星(Youxing Jiang)研究团队与同单位合作者白晓辰(Xiao-chen Bai)在Cell 杂志在线发表了题为Structural mechanism of EMRE-dependent gating of the human mitochondrial calcium uniporter 的研究论文。在该论文中,研究人员首次报导了利用单颗粒冷冻电镜技术解析的人类线粒体钙离子通道——MCU-EMRE复合物的三维结构,分辨率达到3.6Å。该研究揭示了在人类线粒体内膜上EMRE结合并激活MCU的分子机制;与此同时,这一冷冻电镜结构也带给研究人员一个惊奇的发现,即MCU-EMRE复合物在线粒体基质部分发生二聚化,构成一个更高级的复合物(dimer of channel),研究人员推测这种二聚化可能会影响MCU复合物在线粒体中的位置分布,从而调节MCU复合物的生理功能。

人类与真菌MCU的结构在跨膜区形成的钙离子通透孔道部分具有非常好地重合度,说明MCU蛋白具有高度保守的钙离子选择透过机制。二者最大的区别位于线粒体基质部分即卷曲螺旋结构域和N端结构域。
在人类MCU-EMRE复合物的三维结构模型中,EMRE亚基通过C端单次跨膜螺旋、延伸区和N端发卡结构,与MCU亚基以1:1的比例发生广泛而紧密地相互作用,形成四聚体的钙离子通道。这种相互作用使EMRE对MCU结构的调控具有两种主要效应。首先, EMRE使MCU的卷曲螺旋结构域发生外扩,这种外扩使MCU位于线粒体内膜基质侧的loop(图1下图中的luminal gate)拉伸包围成具有严整结构的直径约9Å的孔洞,钙离子通过这个孔洞完成线粒体内膜的穿越流入线粒体基质;其次,不同于真菌MCU N端结构域的垂直环状二重对称四聚体结构,人类MCU N端结构域形成并排的线性四聚体结构,其横切面呈半圆形,在EMRE促使MCU的卷曲螺旋结构域发生外扩的同时,该半圆形N端结构域发生构象变化,提升至位于四聚体通道垂直对称轴的一侧,与垂直部分成L形,这种特殊的构造为更高级的二聚体形式提供了结构上可能性。
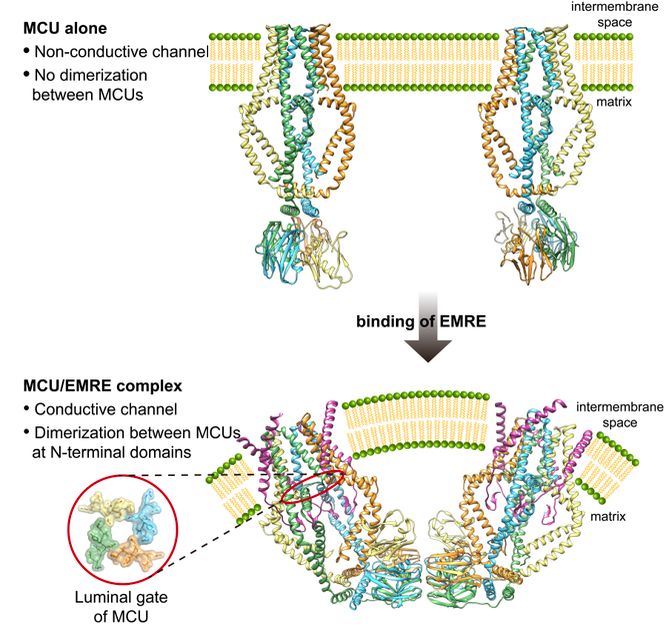
图1
人类线粒体钙离子通道的冷冻电镜整体结构呈V字形,是由两个MCU-EMRE复合物通过MCU N端结构域之间的盐键相互作用而形成的更高级的二聚体。功能实验表明MCU-EMRE复合物的二聚化对线粒体的钙离子吸收不是必需的。研究人员推测,这种二聚化会使MCU复合物富集在线粒体中具有弯曲状态内膜环境的区域——具体而言就是位于接近线粒体外膜的线粒体内膜边缘位置,线粒体内膜从这里向内弯曲,凹陷折叠形成嵴。该区域是线粒体内膜系统最接近线粒体外膜和细胞质的区域,可以使线粒体钙离子通道对细胞质内钙离子浓度的变化具有最敏感的感应,并做出最快的响应。
该项研究成果为进一步研究完整的人类线粒体钙离子通道复合物并阐明该复合物对人类线粒体钙离子吸收的调控机制提供了可靠的结构依据;同时,这种令人惊奇的二聚化方式对于进一步研究这类膜蛋白的位置分布与它们生理功能之间的密切联系开创了新的思路。
据悉,论文的第一作者是得克萨斯大学西南医学中心生理系姜有星课题组的王研博士,论文的共同通讯作者是得克萨斯大学西南医学中心教授姜有星博士和白晓辰博士。
原文链接:https://doi.org/10.1016/j.cell.2019.03.050
参考文献
1. L., Goldberger, O., Bogorad, R.L., et al. (2011). Integrative genomics identifies MCU as an essential component of the mitochodrial calcium uniporter. Nature 476, 341-345.
2. De Stefani, D., Raffaello, A., Teardo, E., Szabo, I., Rizzuto, R. (2011). A forty-kilodalton protein of the inner membrane is the mitochondrial calcium uniporter. Nature 476, 336-340.
3. Nguyen, N.X., Armache, J.P., Lee, C., Yang, Y., Zeng, W., Mootha, V.K., Cheng, Y., Bai, X.C., Jiang, Y. (2018). Cryo-EM structure of a fungal mitochondrial calcium uniporter. Nature 559, 570-574.
4. Baradaran, R., Wang, C., Siliciano, A.F., Long, S.B. (2018). Cryo-EM structures of fungal and metazoan mitochondrial calcium uniporters. Nature 559, 580-584.
5. Fan, C., Fan, M., Orlando, B.J., Fastman, N.M., Zhang, J., Xu, Y., Chambers, M.G., Xu, X., Perry, K., Liao, M., Feng, L. (2018). X-ray and cryo-EM structures of the mitochondrial calcium uniporter. Nature 559, 575-579.
6. Yoo, J., Wu, M., Yin, Y., Herzik, M.A., Jr., Lander, G.C., Lee, .SY. (2018). Cryo-EM structure of a mitochondrial calcium uniporter. Science 361, 506-511.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469697&idx=3&sn=0f9567447846748ba0da6b6b6d611d5f&chksm=84e2ea75b39563632dfe69fd6950bf8c4e19bab0863378b22f14b17788b63b5242f0f65efb43&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新型比率荧光探针:能定位线粒体,还对钙离子有响应
关于突触前钙离子通道的探索和研究

实现高精度可搬运钙离子光频标

中文解读 | 脑出血后铁毒性、脂质过氧化和铁死亡
卤化物钙钛矿中铅离子的环境影响

研究发现高精度检测钙离子新方法
npj:钙钛矿氧硫阴离子顺式排列引起铁电性

“长寿药”首次用到人类身上效果惊人?并非如此!

北方是家鸡的驯化中心?线粒体DNA分析不支持

美国科学家破解植物受伤后传递危险信号的机制