科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-24
来源:BioArt
阿尔茨海默病 (Alzheimer’s disease,AD) 是老年人中最常见的神经系统退行性疾病之一,现今无有效的诊断与治疗手段。AD典型的病理学特征之一是Tau蛋白异常聚集形成的神经原纤维缠结。大量研究表明Tau蛋白异常聚集可以诱发突触毒性,但其分子机制并不清楚。
5月13日,EMBO Rep在线刊发了华中科技大学同济医学院基础医学院病理生理学系刘恭平、王建枝教授团队研究成果:Tau accumulation triggers STAT1-dependent memory deficits by suppressing NMDA receptor expression.

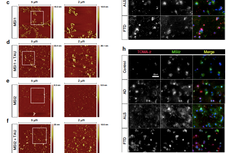
王建枝、刘恭平教授团队在过表达人全长tau(hTau)蛋白的细胞中,发现520种mRNA水平有显著性变化;同时在转录因子活性筛查中发现STAT1转录活性显著上调:于12月龄hTau转基因鼠、过表达AAV-hTau病毒小鼠及AD患者脑组织均发现STAT1的激活;而STAT1的条件性敲除能显著性逆转hTau诱发突触相关蛋白NMDARs的转录抑制和学习记忆障碍。染色质免疫共沉淀发现STAT1能直接结合NMDARs启动子区;荧光素报告基因发现STAT1对NMDARs有转录抑制作用;并发现hTau聚积可激活JAK2,而后者介导了STAT1的磷酸化水平升高与活化。使用STAT1-Y701F失活突变病毒可抑制STAT1激活,逆转hTau诱发的突触毒性作用。该研究发现了htau聚积通过激活JAK2-STAT1通路,抑制NMDARs的转录,从而使突触可塑性下降,导致学习记忆损伤。这一研究结果揭示了AD新的发病机制,可望为AD药物开发提供新的靶标。
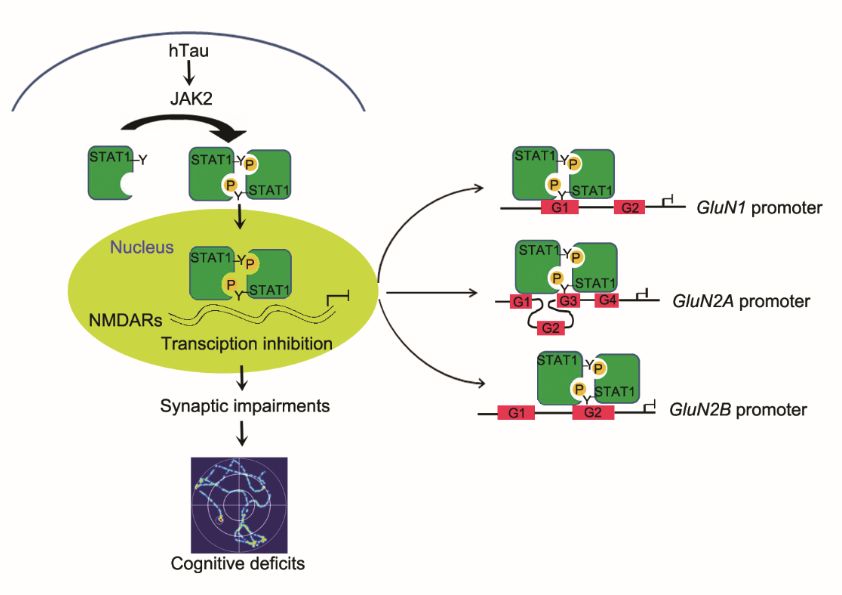
该研究由博士研究生李晓光、洪小月等共同完成。李晓光(王建枝教授2012级直博生)、洪小月(刘恭平教授2016级博士生)为该文的共同第一作者,刘恭平教授、王建枝教授为共同通讯作者,华中科技大学为第一发表单位。
原文链接
http://embor.embopress.org/content/early/2019/05/13/embr.201847202.long
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470413&idx=5&sn=6e58a4e4331f3ccdf7914b66e111d6c4&chksm=84e2ef39b395662ffeb639feea9cd651912a2fc65e1efafe891eb0cdad25fc4f1a9e820f3917&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
提供治疗Tau蛋白相关神经退行性疾病的新治疗靶标——低密度脂蛋白相关蛋白1

JAMA:粉样蛋白(A)、tau蛋白(T)和神经变性生物标志物与记忆下降

Nature:揭示高盐饮食通过促进蛋白tau磷酸化损害大脑认知功能

JAMA Neurol:Aβ、tau蛋白与认知衰退
科学家揭示小分子调控tau蛋白相分离和聚集机制
Cell :翻译后修饰介导tau蛋白致病性的分子结构多样性
科学家绘制tau蛋白细节图

Nat Cell Biol:tau蛋白的“外套”结构和细胞骨架保护机制

Nature子刊:阿兹海默症元凶——tau蛋白也搞性别歧视?
神经退行性疾病研究新方向——MSI/tau蛋白的相互作用