科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-28
来源:BioArt
原标题:Nature Materials | 纳米金-CRISPR系统实现造血干细胞中的基因精准编辑
造血干细胞和祖细胞(HSPCs)的研究历史悠久,也是最早用于移植治疗以白血病、地中海贫血为代表的恶性血液疾病的成体干细胞。虽然HSPCs的异体移植对疾病治疗意义重大,但移植物宿主(GVH)反应依然危害着患者的生命安全;而通过基因治疗改造患者自体的HSPCs或是避免GVH反应是改善患者生存质量的可行策略。
该研究中,研究者以19nm的AuNP为核心,通过低聚乙二醇和巯基接头结合sgRNA,而后利用Cas核酸酶与sgRNA结合的特性,包裹Cas9核酸酶,由此获得大小为40nm的AuNP/RNP运载体可用于基因编辑。为实现精准基因编辑,研究者在已获得的AuNP/RNP复合物表面孵以低分子量的PEI以吸附单链DNA模板,最终获得了高效的AuNP/CRISPR精准基因编辑运载体(下图)。
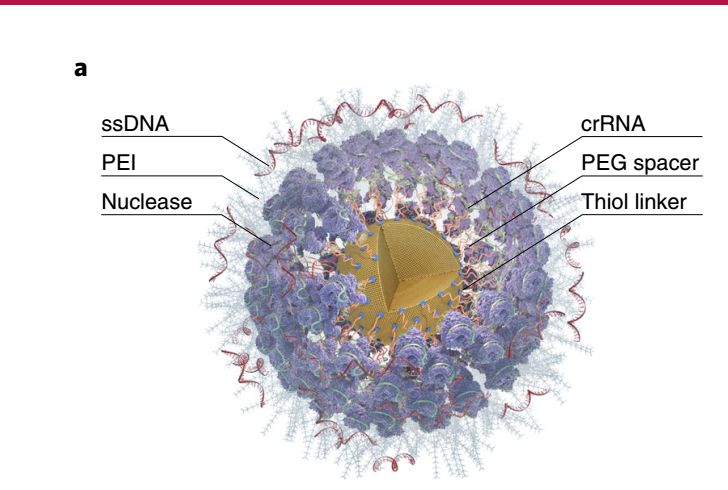
AuNP/CRISPR精准基因编辑运载体示意图。
在HSPCs中,研究者发现,AuNP/CRISPR精准基因编辑运载体可在六小时内成功转染进入细胞。在Cas9与Cpf1的比较中,研究者发现,Cpf1系统更有助于HDR介导的精准基因编辑的发生,这或许与Cpf1诱导产生的带有粘性末端的DSBs有关;与电转染相比,AuNP/CRISPR精准基因编辑运载体可显著提高HDR效率并改善细胞存活状况;而克隆形成实验和小鼠骨髓移植实验发现,AuNP/CRISPR处理对HSPCs的适应性并无明显副作用,且增强了HSPCs在小鼠骨髓中的重建潜能。
总结而言,AuNP/CRISPR精准基因编辑运载体在减少毒副作用、提升HDR介导的精准基因编辑效率和改善HSPCs的移植效果方面均有良好的效果,这对改系统的未来应用有重要意义。AuNP为基础的高效运载体还可进一步用于其它类型的基因编辑平台如单碱基编辑平台,并用于其它的细胞类型中,这将拓展其在医学研究和临床治疗中的应用价值。
原文链接:
https://doi.org/10.1038/s41563-019-0385-5
参考文献
1. Finn, J.D., et al., A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. Cell Rep, 2018. 22(9): p. 2227-2235.
2. Lee, K., et al., Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA in vivo induces homology-directed DNA repair. Nat Biomed Eng, 2017. 1: p. 889-901.
3. Lee, B., et al., Nanoparticle delivery of CRISPR into the brain rescues a mouse model of fragile X syndrome from exaggerated repetitive behaviours. Nature Biomedical Engineering, 2018. 2(7): p. 497-507.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470536&idx=4&sn=974798f4bc09abb39402c507601565d1&chksm=84e2eebcb39567aa7ad5624d6eba882e335aaf7f5fadbef27956e320a7eccbecc249d118a3c3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

再次聚焦CRISPR基因编辑工具和疗法

蚊子怕怕了,利用转基因能破坏它们生育能力,必死无疑
Angew. Chem.:E-CRISPR——不止于基因编辑

基因编辑技术CRISPR有了升级版

Nature: CRISPR开关可使基因编辑更安全

Nature:超越CRISPR的基因编辑技术诞生!

两项研究称CRISPR改造过的细胞或易癌变

基因编辑有重大新进展!两大突破可高效精准矫正致病的遗传突变

CRISPR-Cas系统相关的基因编辑工具详谈
深圳先进院在CRISPR基因编辑应用领域取得新突破