科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-04
来源:BioArt
原标题:PNAS | 梅奥医学中心孙杰组揭示BCL6新功能——促进肺组织特异性中性粒细胞存活及流感病毒诱导的炎症反应
流感病毒(influenza virus)是有包膜的、分节段单股负链RNA病毒,主要感染婴幼儿、老年人、慢性病患者等免疫低下人群,引起以呼吸系统损伤为主的急性感染性疾病,因其传染性高、危害性强,是备受公共卫生学重视的流行病之一。机体感染流感病毒两天后肺组织即有中性粒细胞浸润【1】。该反应为双刃剑:一方面,这些中性粒细胞有助于机体清除病毒,有利于减轻症状;另一方面,大量中性粒细胞富集可导致急性炎症反应,进而损伤肺组织【2】。因此,肺组织中的中性粒细胞的数量必须受到精确调控,以达到既可最大限度清除病毒又不会引起过量炎症反应的效果。但是过量中性粒细胞浸润与流感病毒诱导的呼吸系统炎症反应之间的直接关系尚不明确,且肺组织特异性中性粒细胞在流感病毒感染过程中存活的调控机制仍有待探究。
BCL6是一种特异性的转录因子,在T细胞和B细胞的发育中发挥至关重要的作用【3】。此外,有报道表明BCL6可通过拮抗NF-κB的活性进而抑制巨噬细胞炎症反应【4】。尽管如此,BCL6如何调控宿主抗病毒免疫反应尤其是中性粒细胞反应仍需要深入研究。
近日,美国梅奥医学中心(Mayo Clinic)孙杰教授团队(第一作者为朱碧波博士)在PNAS上发表文章: BCL6 modulates tissue neutrophil survival and exacerbates pulmonary inflammation following influenza virus infection ,首次揭示了BCL6调节肺组织特异性中性粒细胞反应,而对血液循环和骨髓中的中性粒细胞不起作用,这一现象对宿主平衡抗病毒免疫反应和免疫损伤有决定性作用。

本项工作中,研究人员发现髓样细胞特异性缺失BCL6(myeloid cell-specific BCL6-deficient mice )小鼠对流感病毒(PR8毒株)具有很强的抵抗力,有意思的是这一现象不依赖于type I IFN信号通路。进一步深入研究发现髓样细胞特异性BCL6缺失的小鼠肺组织病毒滴度与对照小鼠没有显著差异,并且BCL6缺失不会影响CD8+T细胞功能。但是,髓样细胞特异性敲除BCL6的小鼠的呼吸系统炎症反应显著低于对照组小鼠,肺组织中性粒细胞和炎性单核细胞的浸润减少。作者利用Cre-Loxp系统培育了一系列髓样细胞特异性BCL6缺失小鼠,通过感染PR8,发现中性粒细胞特异性(MRP8-Cre)敲除BCL6的缺陷小鼠呈现出和髓样细胞BCL6缺失小鼠一致的表型,而巨噬细胞或单核细胞BCL6敲除不影响宿主抗病毒反应。这一有趣的现象阐明了中性粒细胞在流感病毒感染中发挥着重要的作用,而中性粒细胞BCL6能调控宿主抗病毒免疫反应。
为了进一步阐明BCL6调控宿主抗病毒免疫反应分子机制,作者利用流式细胞技术分选出BCL6缺失的小鼠肺组织中性粒细胞和对照细胞,分析转录组差异发现,中性粒细胞BCL6缺失上调凋亡相关基因的表达。有趣的是,进一步验证发现,BCL6敲除仅促进肺组织中性粒细胞凋亡而对血液或骨髓中性粒细胞的活性没有影响。ChIP实验的结果也表明只有肺组织中性粒细胞的BCL6能直接结合到凋亡基因的启动子区域。为了揭示过量中性粒细胞浸润加重流感病毒的感染进程,作者利用低剂量Ly6G特异性抗体降低中性粒细胞的数量,结果表明抗体治疗的小鼠对流感病毒的抵抗力增强。
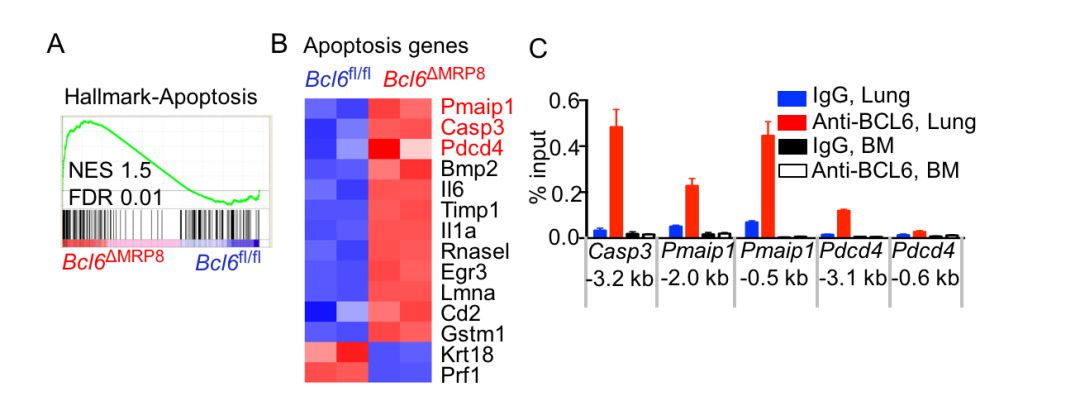
总之,本研究工作首次揭示了 BCL6调控肺组织特异性中性粒细胞的存活,进而调控流感病毒诱导的炎症反应,影响流感病毒感染进程。此发现为流感病毒感染引发的相关疾病和基于过量炎症反应导致的组织损伤的防治提供了理论依据和以组织特异性中性粒细胞为主的潜在靶标,具有重要临床应用价值。
原文链接:
https://www.pnas.org/content/early/2019/05/24/1902310116
制版人:珂
参考文献
1. M. D. Tate et al., Neutrophils ameliorate lung injury and the development of severe disease during influenza infection. J. Immunol. 183, 7441–7450 (2009).
2. M. Brandes, F. Klauschen, S. Kuchen, R. N. Germain, A systems analysis identifies a feedforward inflammatory circuit leading to lethal influenza infection. Cell 154, 197– 212 (2013).
3. A. L. Dent, A. L. Shaffer, X. Yu, D. Allman, L. M. Staudt, Control of inflammation, cytokine expression, and germinal center formation by BCL-6. Science 276, 589–592 (1997).
4. G. D. Barish et al., Bcl-6 and NF-kappaB cistromes mediate opposing regulation of the innate immune response. Genes Dev. 24, 2760–2765 (2010).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470775&idx=6&sn=d5fe13934f19e627d3e94926b72c4133&chksm=84e2ee43b3956755ad228067c853c47c3d673dfcf50ec153f0b256534d8befbef386aef9ee9a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn