科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-19
来源:BioArt
宿主对病毒的先天免疫反应可以通过模式识别受体(pattern recognition receptors,PRRs)识别病毒核酸而触发。这一系列反应应答会导致受NF-κB信号通路调控的促炎症细胞因子的产生以及受干扰素调节因子(IRF)信号通路调节的干扰素的产生【1】。具体来说,在体细胞中,细胞质DNA感受器cGAS(cyclic GMP-AMP synthase,受体环鸟苷酸-腺苷酸合成酶)会识别外源的双链DNA(如病毒)和细胞自身的双链DNA(如受损的线粒体DNA、微核DNA等),在与DNA结合后,会催化产生第二信使环鸟苷酸-腺苷酸(cyclic GMP-AMP dinucleotide, cGAMP)的产生,产生的环鸟苷酸-腺苷酸会结合和激活干扰素刺激蛋白STING,STING蛋白会招募丝氨酸苏氨酸蛋白激酶(TBK1),从而来激活IRF3,最终上调I型干扰素和其它免疫因子的转录。
通常来说,一旦DNA病毒进入宿主细胞,它们就会向宿主细胞核内注射病毒DNA并利用宿主细胞环境复制自身的基因组DNA【2】。尽管cGAS可以在细胞质中发挥DNA感受器的作用,但是当病原性DNA入核后,cGAS并不会感受病原性DNA激活干扰素(此前戈宝学组报道cGAS能够在细胞核内识别dsDNA,没有激活干扰素,而是影响DNA损伤修复,详见BioArt的报道:Nature丨戈宝学/毛志勇合作组揭示cGAS对DNA修复与肿瘤调控的新作用——专家点评),因此有效识别核内病原性DNA对宿主来说至关重要,然而,细胞核内存在何种识别机制以识别病原体DNA保护宿主自体DNA仍然是个未解之谜,也长期充满争议。
目前,已有研究报道了包括cGAS、RNA聚合酶III、IFI16、MRE11(meiotic recombination 11 homolog A)、DNA-PK(heterotrimeric protein complex)等在内的诸多蛋白都可以识别病毒DNA和诱导IFN-α/β的产生【3】,然而,只有细胞质中的cGAS和DNA-PK通过功能性实验在体内验证了它们作为DNA感受器的功能【4,5】。此外,亦有包括Rad50、Sox2、IFI16等在内的蛋白质可以参与DNA病毒诱导的炎症应答过程。
然而迄今为止,科学家们只确认了一种蛋白IFI16(gamma-interferon-inducible protein 16),可以识别细胞核内的DNA病毒从而激活IFN-I的产生和炎性小体的应答(IFI16的争议较大,2016年华盛顿大学医学院Daniel B. Stetson组在Immunity上发文否认了IFI16的上述重要功能)。关于细胞对病原体来源的DNA的核识别和相应的免疫应答调控研究能够帮助人们更全面的认识针对DNA病毒的先天免疫反应,因此,寻找细胞核内其他还未被发现的IFN-I活性启动蛋白意义重大。
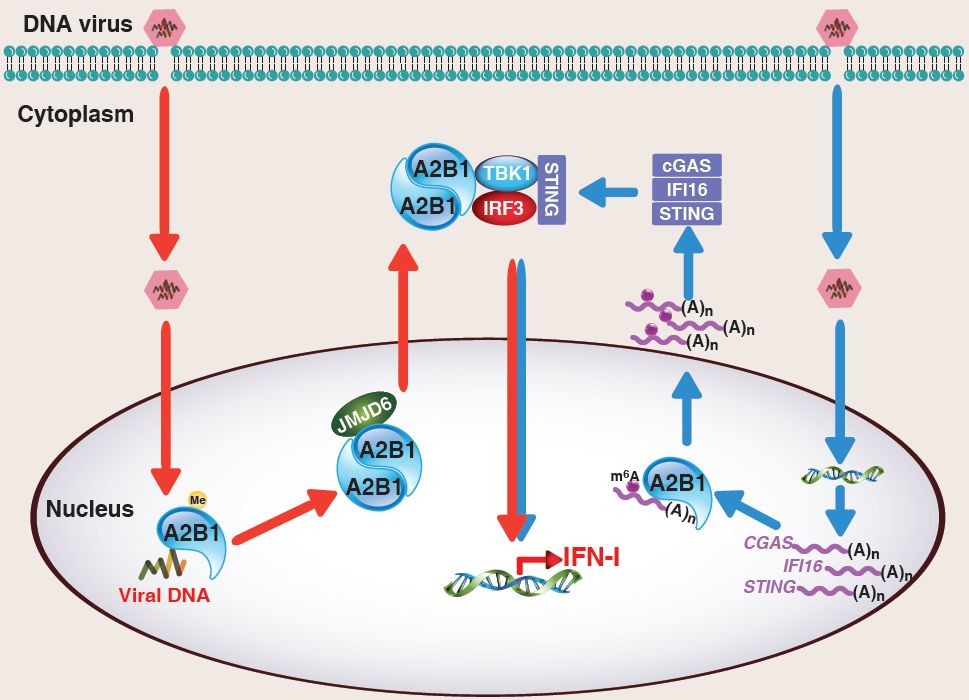
2019年7月19日,南开大学曹雪涛院士团队在Science期刊上以长文形式在线发表了题为Nuclear hnRNPA2B1 initiates and amplifies the innate immune response to DNA viruses的研究论文,报道了一种新型DNA感受器蛋白hnRNPA2B1。当细胞遭受DNA病毒感染时,hnRNPA2B1能够识别病毒DNA并通过自身二聚化启动I型干扰素的产生,并且还可以通过直接增强STING依赖的细胞质DNA感应信号通路增强I型IFN的免疫应答作用,在抗病毒先天免疫反应中发挥了重要作用。

研究伊始,为了寻找潜在的细胞核DNA感应器蛋白,研究人员对HSV-1 (F strain)(Herpes simplex virus-1,单纯孢疹病毒)基因组DNA进行生物素化,随后感染AW264.7细胞,从RAW264.7细胞核提取物中沉淀出DNA结合蛋白,通过质谱分析可能与HSV-1基因组DNA结合的蛋白。同时,研究人员利用2D SDS-PAGE对HSV-1感染后的细胞核蛋白和质蛋白进行分离,然后对HSV-1感染2 h后从细胞核转移至细胞质的蛋白进行质谱分析。结合这两种方法,研究人员鉴定出了23种潜在的病原体来源的DNA结合蛋白。
初步基于siRNA的功能性筛选实验结果,研究人员推测hnRNPA2B1是一种诱导IFN-I的核DNA结合蛋白。hnRNPA2B1与生物素化的HSV-1 DNA的相互作用可以被未标记的HSV-1 DNA竞争性地阻断,人和鼠的DNA也可以竞争性的阻断hnRNPA2B1与生物素化的HSV-1 DNA结合。相比之下,人核小体(基因组DNA被蛋白复合体包裹)却不能阻断这种结合。这表明hnRNPA2B1能结合自体和病原体的DNA。此外,染色体蛋白对自身DNA的包裹能够阻断其与hnRNPA2B1的结合。HSV-1 感染之后通过对hnRNPA2B1进行免疫共沉淀能够在沉淀样品中发现HSV-1 DNA也进一步确认了hnRNPA2B1在感染过程中与HSV-1 DNA 结合。
hnRNPs(Heterogeneous nuclear ribonucleoproteins)由至少20种在人类细胞中丰富存在的蛋白质和少部分不那么丰富存在的蛋白质组成。这些RNA结合蛋白(RNA-binding proteins,RBPs)参与到mRNA剪接、转运以及其他mRNA和miRNA事件中【6】。hnRNPA2B1在N端含有两个串联RNA/DNA识别基序(RRMs),这提示了其具有DNA结合功能【7】。RRMs区域的突变会影响其与HSV-1 DNA的结合,表明了RRMs能够调控hnRNPA2B1识别HSV-1 DNA。
为了阐明hnRNPA2B1在启动IFN-I产生过程中的潜在作用,研究人员对不同小鼠巨噬细胞群中的hnRNPA2B1进行了沉默,发现这样会大大损伤HSV-1诱导的IFN-α,IFN-β,CXCL10的mRNA表达和相应的蛋白产生。在Hnrnpa2b1-KO 的RAW264.7细胞中,HSV-1诱导的Ifnb1表达显著降低,而HSV-1 DNA的复制则增强。此外,DNA病毒腺病毒(AdV)也可以诱导Ifnb1在RAW264.7细胞中的表达,但是RNA病毒或者李斯特菌的感染均不能诱导其表达。因此,hnRNPA2B1对先天免疫介导的DNA病毒复制的抑制具有重要作用。
接下来,研究人员建立了骨髓细胞特异性Hnrnpa2b1-conditional KO(cKO)小鼠。在HSV-1感染后, cKO小鼠原发性腹膜巨噬细胞(PMs)中IFN-β的转录和分泌能力显著降低,cKO小鼠血清中IFN-β水平严重降低。与之伴随的是HSV-1感染后,cKO小鼠的大脑中检测到了更高的病毒滴度。与对照组相比,cKO小鼠感染HSV-1后的死亡率也有所增加。因此,hnRNPA2B1在宿主的先天免疫防御中限制DNA病毒感染发挥了重要作用。
抗病毒先天反应中,I型干扰素是由胞质激酶TBK1以及随后的转录因子IRF3的激活启动转录的【8】。因此,研究人员假设hnRNPA2B1在细胞核中识别病毒DNA后需要转运到细胞质中来激活TBK1-IRF3通路。
在HSV-1感染后2h,hnRNPA2B1主要定位于细胞核中,但是也有部分存在于细胞质中。Hnrnpa2b1的缺失严重影响了TBK1和IRF3的磷酸化,并降低了HSV-1感染后TBK1的激酶活性。基于此,研究人员假设hnRNPA2B1介导的IFN-I诱导需要TBK1。质谱分析结果揭示了hnRNPA2B1与TBK1之间的相互作用关系,同时在小鼠PMs中通过免疫沉淀也验证了这一结果。此外,hnRNPA2B1在HSV-1感染后与TBK1在细胞质中共定位。因此,hnRNPA2B1是在TBK1-IRF3通路的上游调节IFN-β的产生的。
接下来,研究人员试图寻找驱动hnRNPA2B1核质易位的分子机制。有趣的是,研究人员发现hnRNPA2B1在HSV-1感染后发生了二聚化,通过myc和Flag标记的hnRNPA2B1进行的免疫共沉淀结果也证实了这一点。在RRM结构域发生的二聚体界面突变(Pro81,Lys82,Arg83,Val172,Arg173,Lys174)会破坏HSV-1感染后的hnRNPA2B1的二聚化和核质易位。在二聚体界面带有突变的hnRNPA2B1不能够拯救HSV-1诱导的Ifnb1 mRNA表达降低的情况。尽管如此,这些二聚体突变体不会影响hnRNPA2B1结合病毒DNA的能力。因此,hnRNPA2B1是通过RRM结构域识别和结合HSV-1 DNA,并且通过该结构域诱导hnRNPA2B1二聚化,从而驱动其核质易位,激活TBK1。
那么,hnRNPA2B1是否会被自身DNA激活?通过核转染裸露人核小体DNA的确可以激活IFNB1表达,而组装好的核小体却不能。因此核转染裸露人核小体DNA后可以检测到hnRNPA2B1二聚体。因此,染色体蛋白质能够阻止hnRNPA2B1被基因组自身DNA的活化。
接下来,研究人员研究了hnRNPA2B1在HSV-1感染时是如何激活TBK1的。研究人员发现在HSV-1感染后的小鼠巨噬细胞和人类THP1细胞内,hnRNPA2B1会与Src和STING相互作用。STING和TBK1会显著增加hnRNPA2B1介导的IFN-β诱导。因此,Src可能是hnRNPA2B1信号复合物的上游激酶来激活TBK1。正如所料,HSV-1感染后,磷酸化的Src与hnRNPA2B1和活化的TBK1在巨噬细胞中共定位。此外,在没有hnRNPA2B1的情况下,Src磷酸化受到严重影响。这些结果表明,核内的hnRNPA2B1在识别病原体来源的DNA后会形成同源二聚体,驱动其从核易位至细胞质,从而通过Src结合并活化TBK1-IRF3信号,起始STING依赖的IFN-α/β表达。
蛋白质翻译后修饰对蛋白质的功能调控起重要作用。紧接着,研究人员对hnRNPA2B1上的精氨酸、丝氨酸和苏氨酸进行点突变,观察这些突变后对hnRNPA2B1诱导的Ifnb1表达的影响。结果发现,在精氨酸-甘氨酸- 5 -甘氨酸丰富(RGG)结构域中的Arg226 (R226A)突变能够显著增强hnrnpa2b1诱导的Ifnb1表达。在Hnrnpa2b1-KO RAW264.7细胞中过表达hnRNPA2B1-R226A较过表达野生型hnRNPA2B1会导致IFN-β mRNA水平和蛋白水平的上升。早前的研究报道了hnRNPA2B1 RGG结构域上的精氨酸残基会发生甲基化【9】,HSV-1感染后hnRNPA2B1上的精氨酸单甲基化水平降低,在所有精氨酸残基位点中,R226是精氨酸单甲基化的关键位点。巨噬细胞感染HSV-1后,hnRNPA2B1的R226位点会发生去甲基化。同时,质谱分析结果表明hnRNPA2B1与去甲基化酶JMJD6之间存在着相互联系,在小鼠PMs细胞和人THP1细胞的免疫沉淀实验中,研究人员证实了HSV-1感染后内源性的hnRNPA2B1与JMJD6之间存在的相互作用。此外,研究人员发现这种相互作用是短暂的,因为hnRNPA2B1会转移至细胞质,而JMJD6则会滞留在细胞核中。
由于JMJD6的去甲基化活性需要其自身寡聚化,研究人员推测JMJD6可能在先天防御DNA病毒感染中发挥作用。利用Noxalylglycine(NOG)对JMJD6进行抑制会损伤HSV-1感染后hnRNPA2B1的去甲基化进程。在巨噬细胞中敲减JMJD6或是抑制JMJD6也会造成HSV-1诱导的Ifnb1表达显著降低。这种对Ifnb1产生造成损伤的现象可以通过过表达hnRNPA2B1-R226A得到拯救。相比之下,JMJD6过表达会促进HSV-1诱导的Ifnb1产生。因此,hnRNPA2B1是通过JMJD6在R226位点的去甲基化被激活。有趣的是,hnRNPA2B1二聚体表面的突变体hnRNPA2B1-DI 会使得精氨酸的甲基化水平上升,而该突变体不能在HSV-1感染后与JMJD6相互作用。此外,NOG对JMJD6的抑制作用并不会影响HSV-1感染后巨噬细胞中hnRNPA2B1的易位现象。因此,在识别病毒DNA后,hnRNPA2B1在细胞核中二聚化并被JMJD6去甲基化。hnRNPA2B1的二聚化是其去甲基化和易位所必需的。
接下来,研究人员探讨了核hnRNPA2B1和识别的DNA感受器蛋白通路是如何启动抗病毒IFN-I产生的。在Cgas -/- L929细胞中过表达野生型hnRNPA2B1和R226A突变体会显著增加HSV-1诱导的Ifnb1表达。同时,R226A突变体的过表达还增强了HSV-1诱导的TBK1活性。说明hnRNPA2B1至少可以通过不依赖于cGAS的方式部分诱导IFN-I的产生,这也与先前发现存在其他分子可以部分补偿cGAS缺失的损失相一致。
在Hnrnpa2b1-KO PMs中HSV-1诱导的Ifnb1表达减弱。牛痘病毒(Vaccinia virus,VACV)是另一种DNA病毒,它可以在细胞质中复制并由胞质DNA感受器蛋白感知。VACV感染Hnrnpa2b1-KO PMs 4h 后,诱导产生的Ifnb1达到一定水平,但随后Ifnb1水平并没有像在野生型细胞中那样增加。在对两种病毒的应答过程中,野生型巨噬细胞较Hnrnpa2b1-KO巨噬细胞而言均产生更高和持续性的Ifnb1表达。因此,cGAS-,IFI16-,STING-介导的应对病毒DNA的途径或许需要hnRNPA2B1以充分激活I型干扰素的表达。
在HSV-1感染6h后,内源性的cGAS,p204(人源IFI16的鼠同源物)和STING蛋白水平在野生型和Hnrnpa2b1-KO RAW264.7细胞中是一样的,但是在野生型细胞中,6h之后,cGAS水平会再次上升,p204水平在12h之后也再次上升,而在KO细胞中这些蛋白水平并不会再次增加。并且在KO细胞中,6h感染后,STING蛋白水平下降的速度更快。因此,在DNA病毒感染后,hnRNPA2B1是有效诱导cGAS,IFI16,STING活化,随后产生抗病毒IFN-I应答所必需的。
此外,研究人员发现在野生型和KO的RAW264.7细胞中Cgas,p204,Sting的mRNA转录水平是相似的,但是hnRNPA2B1的缺失会导致Cgas,p204,Sting mRNA在核中停留。对与hnRNPA2B1免疫沉淀复合物相关的mRNA进行分析发现hnRNPA2B1在HSV-1感染后的巨噬细胞中可以结合Cgas,p204和Sting的mRNA。因此,hnRNPA2B1在介导这些mRNA的核质易位中发挥着作用。
m6A是哺乳动物mRNA的主要甲基化碱基,并且可以促进mRNA从细胞核到细胞质的易位作用。对HSV-1感染后细胞内大量的甲基化mRNAs进行提取分析,发现甲基化的Cgas,p204和Sting mRNA含量在Hnrnpa2b1-KO RAW264.7细胞中较对照组明显偏低。因此,参与抗病毒反应的特定类别的mRNA,如Cgas、p204和Sting,在DNA病毒感染后会以hnRNPA2B1依赖的方式进行m6A修饰(2015年,Cell论文报道过hnRNPA2B1可以被当做m6A的阅读器【10】,另外,关于m6A修饰与天然免疫调控的研究2018年年底发表在Nat Immunology上的文章有过简单的报道,由于是在细胞系中得出相对比较简单的结论,需要注意的是在不同的体系中m6A修饰对于天然免疫调控的作用是不同甚至相反的【11】)。
细胞中存在着两种RNA去甲基化酶 ALKBH5和FTO,同样地,质谱结果表明hnRNPA2B1与FTO之间存在着相互作用,在鼠PMs和人THP1细胞中感染HSV-1发现hnRNPA2B1与FTO确实存在相互作用,敲减FTO会导致巨噬细胞中Ifnb1表达的上升。
去甲基化的hnRNPA2B1与CGAS,IFI16和STING mRNAs的结合会严重受损,而这些mRNA的m6A水平在JMJD6抑制剂处理后的细胞中是与对照组相似的。因此,hnRNPA2B1结合RNA需要Arg226位的甲基化,并且去甲基化的hnRNPA2B1不能够与这些mRNAs结合或者影响它们的m6A修饰。
综上所述,这些结果表明hnRNPA2B1与FTO之间存在动态相互作用。这种相互作用反过来会影响CGA,IFI16和STING的mRNAs的m6A修饰,并调节它们的核质转运和翻译以应对DNA病毒感染。
总的来说,本研究阐明了当携带DNA的病毒进入细胞,随后将自身基因组DNA注射进细胞核后,会被hnRNPA2B1识别。hnRNPA2B1识别病毒DNA后,会形成同源二聚体并且由去甲基化酶JMJD6介导其去甲基化。这一系列过程导致hnRNPA2B1从细胞核转移到细胞质,在细胞质中它激活TBK1-IRF3通路并且启动IFN-α/β的产生。同时此外,hnRNPA2B1也能够促进CGAS,IFI16,和STING mRNA上的m6A修饰,翻译以及核质转移以及翻译,从而确保IFN-α/β的活化以应答DNA病毒的感染。因此hnRNPA2B1在形成抗病毒先天免疫应答中起着至关重要的作用。
尽管过去有许多研究声称找到了细胞核内感知DNA病毒的关键蛋白,但是目前为止并没有一个天然免疫领域内公认的核心感受器。曹雪涛院士研究组的这项工作开启了细胞核内病毒DNA感受器调控天然免疫的新方向,是天然免疫领域的重要发现。当然,后续仍然有许多问题需要进一步去阐明,例如hnRNPA2B1是否能感知RNA病毒?hnRNPA2B1是否能感知核内损伤的DNA片段(cGAS有报道可以识别dsDNA)?m6A修饰调控天然免疫的详细分子机制?催化hnRNPA2B1精氨酸甲基化的酶?
原文链接:
https://science.sciencemag.org/content/early/2019/07/17/science.aav0758
参考文献
1. T. Kawai, S. Akira, The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat Immunol 11, 373-384 (2010).
2. M. Marsh, A. Helenius, Virus entry: open sesame. Cell 124, 729-740 (2006).
3. J. Wu, Z. J. Chen, Innate immune sensing and signaling of cytosolic nucleic acids. Annu Rev Immunol 32, 461-488 (2014).
4. B. J. Ferguson, D. S. Mansur, N. E. Peters, H. Ren, G. L. Smith, DNA-PK is a DNA sensor for IRF-3-dependent innate immunity. Elife 1, e00047 (2012).
5. X. D. Li, J. Wu, D. Gao, H. Wang, L. Sun, Z. J. Chen, Pivotal roles of cGAS-cGAMP signaling in antiviral defense and immune adjuvant effects. Science 341, 1390-1394 (2013).
6. S. P. Han, Y. H. Tang, R. Smith, Functional diversity of the hnRNPs: past, present and perspectives. Biochem J 430, 379-392 (2010).
7. J. Ding, M. K. Hayashi, Y. Zhang, L. Manche, A. R. Krainer, R. M. Xu, Crystal structure of the two-RRM domain of hnRNP A1 (UP1) complexed with single-stranded telomeric DNA. Genes Dev 13, 1102-1115 (1999).
8. K. A. Fitzgerald, S. M. McWhirter, K. L. Faia, D. C. Rowe, E. Latz, D. T. Golenbock, A. J. Coyle, S. M. Liao, T. Maniatis, IKKepsilon and TBK1 are essential components of the IRF3 signaling pathway. Nat Immunol 4, 491-496 (2003).
9. J. D. Gary, S. Clarke, RNA and protein interactions modulated by protein arginine methylation. Prog Nucleic Acid Res Mol Biol 61, 65-131 (1998).
10. Alarcón, C. R., Goodarzi, H., Lee, H., Liu, X., Tavazoie, S., & Tavazoie, S. F. (2015). HNRNPA2B1 is a mediator of m6A-dependent nuclear RNA processing events. Cell, 162(6), 1299-1308.
11. Winkler, R., Gillis, E., Lasman, L., Safra, M., Geula, S., Soyris, C., ... & Trilling, M. (2019). m 6 A modification controls the innate immune response to infection by targeting type I interferons. Nature immunology, 20(2), 173.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472824&idx=1&sn=e410976c73cbf73a8a0258e628d005f5&chksm=84e2164cb3959f5aa62167287bfce0d78a9903d15c8e5a3bff13768941b16f3337458290d0f2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
DNA DNA甲基化 细胞核 细胞质 甲基化 dna修复 dna提取 dna复制

新研究揭开人类头发曲直的秘密
Nat Plants:植物如何防晒?抑制DNA甲基化
研究揭示成瘾行为形成DNA去甲基化调控机制

揭示小RNA介导DNA甲基化调控水稻分蘖分子机制

【分享】APELA基因在子痫前期中的DNA甲基化
演化:“最奇怪动物”身份揭秘
Trends in Plant Science:DNA甲基化:提高作物抗病性
研究发现DNA甲基化参与调控柑橘成熟新机制

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人
科学家绘制正常组织DNA甲基化单体图谱