科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-15
来源:中国生物技术网
最近,中国科学院微生物研究所钱韦研究组在PLoS Pathogens上在线发表了一项题为Cyclic-di-GMP binds histidine kinase RavS to control RavS-RavR phosphotransfer and regulates the bacterial lifestyle transition between virulence and swimming 的成果,该研究发现一种细菌控制生活方式转变的生物化学新机制。
绝大多数动、植物病原细菌是所谓条件型致病菌(opportunistic pathogen)。这类病原在正常生存(free-living)时对寄主无害甚至有益。但是,当它们侵入到寄主体内,或进入到非正常生活的寄主组织中,细菌可能因生境发生剧烈变化(比如受到免疫系统的攻击)而表达毒力因子,转而用毒性生活(virulence)来保护自己。例如,共生于人类皮肤表面的金黄色葡萄球菌、铜绿假单胞菌、链球菌等细菌对人体无害,而一旦通过伤口进入体内则可能导致严重感染和各种机体炎症。因此,对于条件致病型细菌而言,从自由生存到毒性生活的相互转变是其生存斗争的需要,受到细菌细胞感知系统的精细控制。
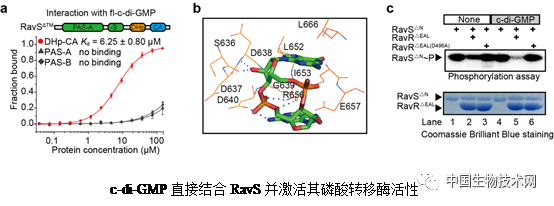
这项新研究发现:植物病原细菌-野油菜黄单胞菌细胞内一个名为RavS的受体在控制细菌生存方式转变中发挥着重要作用:RavS是一种组氨酸激酶,当其处于高磷酸化水平时,它控制细菌游动,但抑制细菌的毒力;但当RavS处于低磷酸化水平时,它虽然对毒力没有控制作用,但却抑制细菌的游动性。因此,当细菌需要从自由生存状态向毒性状态转变时,RavS的磷酸化水平必须下降到较低水平。研究发现,这一下降过程是由细菌细胞内第二信使分子c-di-GMP(环二鸟苷单磷酸)严格控制的:c-di-GMP直接接合到RavS的ATP酶区,显著增强了它的磷酸转移酶活性。在将磷酸基团“甩”给下游反应调节蛋白RavR以后,RavS的磷酸化水平自然回归到较低水平,从而解除对细菌毒力因子表达的抑制作用。因此,c-di-GMP信号分子与受体RavS的相互作用是调控细菌自由生活向毒性转变的关键环节。
值得注意的是,在上述控制过程中,细菌双组分信号转导系统RavS-RavR之间的特异性关系不但决定于这两个蛋白的一级序列,而且需要c-di-GMP信号分子的驱动。因此,研究新发现了一种控制细菌双组分信号转导系统特异性的生物化学机制,并为发展新型抗菌化合物提供了关键分子作用靶标。
该研究主要由钱韦研究组的博士后程寿廷完成。此项研究得到国家重点研发计划、中科院战略性先导科技专项和国家杰出青年科学基金等的联合资助。
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653944433&idx=2&sn=a23a620d116f91fc26e7d214da13912b&chksm=bd130a188a64830ee76e226cc58150ed703105d87aa81a4b7e727270387430205f3a3be7b290&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
银与细菌“携手”,微生物燃料电池效率倍增
微生物所等揭示细菌III型分泌系统调控机制
微生物所揭示植物识别病原细菌的新机制
微生物所等揭示细菌III型分泌系统调控机制
最新研究:口腔细菌在会破坏阴道微生物组的平衡

病毒和细菌如何在肠道微生物群中相互平衡

微生物-花粉互作研究新突破!花蜜细菌刺激花粉萌发和爆裂以增强微生物适应性
石远凯:探索抗癌新药
微生物所发表中国微生物组数据平台
真相:桃子和西瓜一起吃有剧毒?谣言卷土重来,你又信了?