科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-13
来源:生物通
研究人员已发现了一系列针对type I和type II CRISPR-Cas系统的Acr蛋白,并且其中多个Acr蛋白的抑制机理已被阐明,具有非常明显的特异性和多样性。
原核生物通过一系列的防御系统来抵抗噬菌体等寄生生物的攻击。与真核生物的免疫系统类似,原核生物的防御系统也可以分为天然免疫系统和获得性免疫系统。天然免疫系统又包括限制性修饰(Restriction-Modification, R-M)系统、DNA干扰、毒素-抗毒素系统等,是非特异性的防御措施;而获得性免疫系统是高度特异性的防御手段,其典型代表为CRISPR-Cas系统。
近年来,针对CRISPR-Cas系统的作用机制研究取得了一系列重要进展,这类系统的序列特异性核酸剪切活性能够对多种细胞和生物的基因组进行有效编辑,在基因工程和生物医学等多个领域显示出了巨大应用潜力。其中最受关注的是Cas9(type II)和Cas12a(type V)系统,二者都被设计和改造成高效精准的基因编辑工具,而Cas13a(type VI)系统也被开发成为高灵敏性的核酸检测系统。
为了逃逸宿主的CRISPR-Cas免疫作用,噬菌体也进化出了多种anti-CRISPR(Acr)蛋白来抑制宿主菌体内CRISPR-Cas系统的功能。目前为止,研究人员已发现了一系列针对type I和type II CRISPR-Cas系统的Acr蛋白,并且其中多个Acr蛋白的抑制机理已被阐明,具有非常明显的特异性和多样性。
2018年,Jennifer A. Doudna[1]和Joseph Bondy-Denomy[2]两个课题组分别利用不同的方法发现了三个靶向type V效应蛋白Cas12a的Acr蛋白(AcrVA1、AcrVA4、AcrVA5)并在哺乳动物细胞内显示出有效抑制活性。随后,Dong[3]等人发现AcrVA5通过对Cas12a进行乙酰化修饰来影响PAM基序的识别,从而抑制靶标双链DNA(dsDNA)的结合。同时,Knott[4]等人报道AcrVA1能够剪切与Cas12a结合的CRISPR RNA (crRNA)的spacer序列,从而阻断DNA靶标链与crRNA互补配对;并且他们通过生化实验证明了AcrVA4能够影响靶标DNA的结合,但其具体作用机理仍不清楚。
此外,在这三个Acr蛋白中,AcrVA4具有最高的抑制效率,并且能同时抑制莫拉氏菌(Moraxella bovoculi, MbCas12a)和毛螺菌编码的Cas12a(Lachnospiraceae bacterium, LbCas12a)蛋白活性,而LbCas12a已被广泛应用于多种细胞的基因编辑。因此,揭示AcrVA4抑制Cas12a活性的分子机制对于开发有效的基因编辑调节工具具有重要意义。
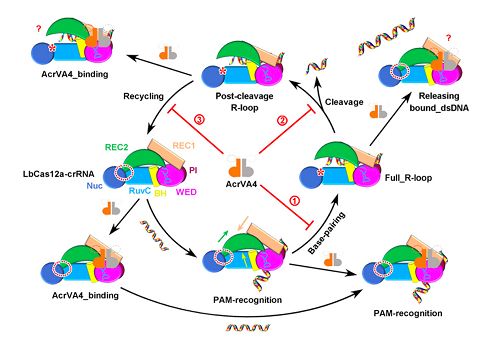
最新研究通过体外结合实验,发现AcrVA4能够与LbCas12a-crRNA二元复合物以及切割前后两种状态的LbCas12a-crRNA-dsDNA三元复合物结合,但是不能结合单纯的Cas12a蛋白,表明AcrVA4识别Cas12a的特定构象。随后,研究人员利用冷冻电镜单颗粒三维重构技术,解析了AcrVA4与LbCas12a-crRNA结合的原子分辨率的三维结构。
结构显示AcrVA4以同源二聚体形式存在,并且与一个或两个LbCas12a-crRNA二元复合物进行结合。在两种形式的复合体中,AcrVA4通过类似的机制与Cas12a相互作用,表明两种结合模式具有相同的抑制作用。
进一步结构分析表明,AcrVA4利用其C端结构域与LbCas12a的多个结构域发生相互作用并锁定其构象,从而阻止靶标DNA与crRNA的spacer序列进行互补配对,进而阻断DNA切割反应。有趣的是,当AcrVA4与切割前状态的LbCas12a-crRNA-dsDNA三元复合物(R-loop状态)相互作用时,能够将结合的dsDNA剥离下来,从而拯救被捕获的靶标DNA使其不被切割。此外,AcrVA4还能与切割后的LbCas12a-crRNA-dsDNA复合物结合并具有较高亲和力,这可能会干扰Cas12a被新的crRNA重置,阻断酶的循环利用过程。
这项工作系统地研究了AcrVA4抑制CRISPR-Cas12a系统的分子机制。与其他已知Acr蛋白的单一抑制机制不同,AcrVA4能够在反应过程中的多个步骤影响Cas12a发挥活性。这些发现拓展了我们对于Acr蛋白作用机制的了解,为设计可调控的基因编辑系统提供了重要理论基础。
参考文献:
Structural insight into multistage inhibition of CRISPR-Cas12a by AcrVA4
来源:gh_c1fce5726992 生物通
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675530606&idx=4&sn=297771cbe537dcf32b3849fecd9c72cc&chksm=bc51f2ff8b267be98cc2c46ac8e1366d7ed9e9512d0fea0f81d17b64ac210d9b6b7c749a8334&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
DNA多聚酶
DNA修复之谜
王艳丽:做研究就像破案
75%DNA是垃圾
寻找环境古DNA
古DNA研究概览
环状DNA测序工具面世

自然中不存在的蛋白质也能人造了!撼动材料医药界
DNA科普漫画(一)——致DNA的美丽邂逅



DNA王朝内幕