科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-17
来源:交大新闻网
细胞铁死亡(Ferroptosis)是新近发现的一种新型细胞程序性死亡,2012年首次鉴定了这种细胞死亡方式。目前,关于细胞铁死亡机制的研究主要集中在细胞质事件上。已有的研究表明,细胞铁死亡的发生主要与脂质活性氧(Lipid ROS)在细胞内的积累有关,该脂质活性氧的积累依赖于铁离子的存在。表观遗传修饰显著影响基因的表达,进而调控不同生物学过程,是连接外界诱导信号与不同生物学功能的重要纽带。以组蛋白修饰为代表的细胞核事件是否参与细胞铁死亡的调控?人们对此知之甚少。
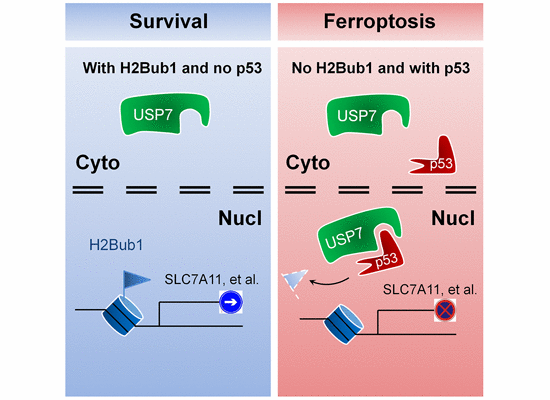
为了探索表观遗传修饰在细胞铁死亡中的可能调控作用,西安交通大学医学部法医学院陈苏研究组以细胞铁死亡发生过程中组蛋白修饰的动态变化为切入点,系统筛选了在细胞铁死亡诱导过程中不同组蛋白修饰的动态变化规律,寻找细胞铁死亡调控中可能发挥作用的组蛋白修饰,揭示了组蛋白H2B单泛素化修饰(H2Bub1)在调控细胞铁死亡中的重要作用以及p53调控H2Bub1的分子机制及其在细胞铁死亡调控中的重要作用。研究发现,组蛋白H2B的单泛素化修饰(H2Bub1)在细胞铁死亡诱导过程中显著下调,人为抑制内源H2Bub1的水平可以使细胞对铁死亡诱导剂Erastin的敏感性显著增加。同时,研究人员还发现,细胞铁死亡的关键调控蛋白SLC7A11(胱氨酸/谷氨酸逆向转运体组分)是一个新的H2Bub1下游靶基因,H2Bub1通过对SLC7A11表达的调控参与细胞铁死亡的调节。此外,研究人员还发现,肿瘤抑制蛋白p53是一个新的H2Bub1的负调控蛋白,p53主要通过促进H2Bub1的去泛素化酶USP7的核转位来下调H2Bub1水平。同时,该p53-USP7-H2Bub1信号轴,同样在细胞铁死亡调控中发挥重要作用。值得一提的是,今年是p53发现40周年,该工作不仅揭示了H2Bub1调控细胞铁死亡的分子机制,还揭示了一项p53对染色质调控的新机制,为进一步理解p53的生物学功能提供了新观点。此外,为纪念p53发现40周年和RNA聚合酶发现50周年,今年5月份在杭州举办了2019分子细胞生物学国际前沿论坛,该工作进行展示。
近日,上述研究成果在国际学术期刊欧洲分子生物学组织报告(EMBO Reports)在线发表,论文题目为《H2B单泛素化修饰和p53介导的细胞铁死亡表观遗传调控机制》(Epigenetic regulation of ferroptosis by H2B monoubiquitination and p53)。陈苏研究组博士生王雨霏为该论文的第一作者,该研究得到合作单位济宁医学院和河北省遵化市人民医院等的大力支持与帮助,陈苏研究员与济宁医学院崔文教授为共同通讯作者。该研究得到国家自然科学基金委、中国博士后科学基金会以及西安交通大学的资助。
文章链接:http://embor.embopress.org/content/early/2019/05/22/embr.201847563
陈苏研究组主页:https://chensubio.wixsite.com/thechenlab

Cell Res:蓝斐等发现表观遗传调控减数分裂过程

乔红团队揭示乙烯信号传导表观遗传调控新机制

表观遗传调控植物性别分化
遗传发育所在小麦胚发育的表观组调控方面取得进展

表观遗传调控水稻籽粒大小的新机制
化学所在RNA表观遗传修饰的化学调控研究方面取得进展
新发现:蛋白质MLL2会影响卵细胞的表观遗传
遗传学与表观遗传学前沿暨第三届中国青年遗传学家论坛会议纪要



关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知

揭示桃树花芽休眠的表观遗传调控机制