科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-18
10月1日,EMBO Journal 在线发表了中国科学院广州生物医药与健康研究院刘兴国研究组和裴端卿研究组的题为Heterochromatin loosening by the Oct4 linker region facilitates Klf4 binding and iPSC reprogramming 的最新研究成果。
该研究发现重编程因子中Oct4主要起到松散解离异染色质的作用,而且,Oct4作为解离异染色质的先导因子,调控Klf4对其下游靶点的结合,进而调控“间充质-上皮转换(MET)”这一重编程早期的关键事件。
机制研究发现,Oct4是通过招募ATP依赖的染色质重塑蛋白如Brg1等来解离异染色质。这一工作揭示了单个重编程因子打开染色质从而有助于其它因子结合到目标基因的全新协同模式。
2006年,日本科学家Yamanaka成功利用转录因子Oct4、Sox2、Klf4将小鼠胚胎成纤维细胞诱导成了多能性干细胞(iPSC)。染色质分为常染色质和异染色质,前者处于伸展状态,有转录活性,后者处于聚缩状态,无转录活性,两者的相互转换是细胞命运转变的关键。
与体细胞相比,多能干细胞的染色质呈相对松散开放的状态,异染色质少。因此,体细胞重编程过程需要发生染色质的重塑才能成功诱导出iPSC来。
许多研究团队在不同侧面的分子水平描述了重编程过程中染色质的变化。然而,哪个(些)重编程因子行使着解离体细胞的丰富异染色质的功能却还未被阐明。
刘兴国聚焦于亚细胞水平的细胞器重塑调控重编程的机制,他的团队利用成像学等方法系统地阐明了细胞器的组分重塑(Xingguo Liu*,Autophagy,2017)、离子信号(Xingguo Liu*,Cell Metabolism,2016,2018)、能量代谢(Xingguo Liu*,Stem Cells,2016) 等调控多能性的获得。
而对于细胞核这一最重要的细胞器,研究团队在前期工作中开发了活细胞内实时精确定量常染色质和异染色质的松散性的成像方法,通过红色荧光(HP1a-mCherry)用于区分常异染色质,绿色荧光(H1-GFP)的光漂白后荧光恢复(FRAP)用于定量外周组蛋白的活跃程度,从而分别定量分析常异染色质的松散性。研究人员将这一成像方法实时应用于体细胞重编程中,发现在体细胞重编程早期,只有异染色质显著变松散,常染色质没有明显变化,并筛选鉴定出染色质松散因子Gadd45a作为新型因子,能显著提高重编程效率(Xingguo Liu* and Duanqing Pei*,EMBO Reports,2016; Xingguo Liu*,Cell Death and Disease,2017)。在此研究基础上,刘兴国组进行了持续的研究,将常异染色质的FRAP技术应用到回答“哪个(些)重编程因子解离体细胞异染色质”这一基本科学问题上。
Klf4的靶基因大多处于异染色质,这就像Klf4要到目的地去,却被异染色质上锁了,而Klf4能否到目的地调动靶基因,决定着体细胞能否从间充质状态变身为上皮状态从而启动重编程。Oct4能精确“解锁”异染色质的钥匙位于其连接区域的L80位点,使Klf4可以轻松地到达目的地结合靶基因,启动“间充质-上皮转换”。当该位点突变后,Oct4不能招募Brg1,失去解离异染色质的能力,进而不能成功诱导出iPSC。
在该突变体介导的体细胞重编程早期,间充质-上皮转换过程很弱;同时在后期,也不能激活多能性基因的表达。
课题组早期鉴定的染色质解离因子如Gadd45a等能很好地补救Oct4-L80A突变体的功能,让异染色质解离,并促进Klf4的结合和间充质-上皮转换,最后激活多能性基因,成功诱导出iPSC。
该研究不仅确定Oct4在重编程中“解锁”异染色质的先导作用,而且阐明Oct4和Klf4在染色质水平的互作调控细胞命运转变。
该研究与德国马普分子生物医学研究所教授Hans R Scholer合作完成。该研究获得国家重点研发项目、中科院、国家自然科学基金、广东省和广州市的经费支持。
文章链接
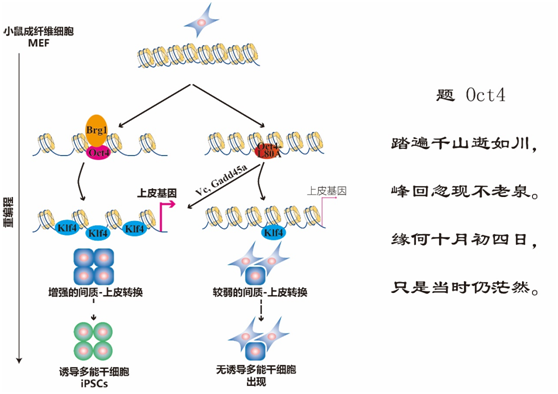
图:重编程中Oct4“解锁”异染色质
内容来源:中国科学院来源:中国科学院
原文链接:http://www.cas.cn/syky/201910/t20191016_4720435.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn