孙熙宸
加好友
孙熙宸 2019-10-25
来源:BioArt
寡核苷酸重复序列扩增与40多种神经肌肉和神经退行性疾病相关。这些疾病的病理机制与重复扩增的核苷酸序列、扩增数目、重复序列所在基因及所在基因的部位均相关【1】。肌萎缩脊髓侧索硬化症(Amyotrophic lateral sclerosis, ALS),是一种表现为上、下运动神经元进行性退变,并最终发展为致死性瘫痪的疾病。目前,越来越多的研究认为ALS与另一种表现为言语障碍及行为异常的神经退行性疾病——前额颞叶痴呆(Frontotemporal dementia, FTD)在临床表现、病理机制及基因遗传上有很多关联【2】。C9ORF72基因非编码区的六核苷酸GGGGCC重复序列异常扩增被认为是导致遗传性ALS及FTD的重要致病基因【3,4】。(GGGGCC)n重复序列相关的非AUG介导翻译(Repeat Associated Non-AUG translation,RAN 翻译)由于能在所有阅读框进行翻译产生聚甘氨酸-丙氨酸(poly Glycine-Alanine,GA)、聚甘氨酸-脯氨酸(poly Glycine-Proline,GP)和聚甘氨酸-精氨酸(poly Glycine-Argine,GR)这三种具有神经毒性的二肽重复蛋白(Dipeptide repeat proteins,DPRs),被认为是C9ORF72基因突变介导的ALS/FTD的重要致病机制之一【5】。探索能降低DPRs水平的方法将会对治疗C9ORF72-ALS/FTD患者具有重要意义。然而目前,对于C9ORF72 (GGGGCC)n RAN翻译产物DPRs的调控机制所知甚少。
2019年10月3日,美国约翰霍普金斯大学神经病理系孙疏影团队(共同第一作者为程维维和王少朋博士)在Neuron发表了题为 CRISPR-Cas9 Screens Identify the RNA Helicase DDX3X as a Repressor of C9ORF72 (GGGGCC)n Repeat-Associated Non-AUG Translation 的研究论文,发现了RNA解螺旋酶DDX3X可调控C9ORF72 (GGGGCC)n 的RAN翻译产物及其分子机制。

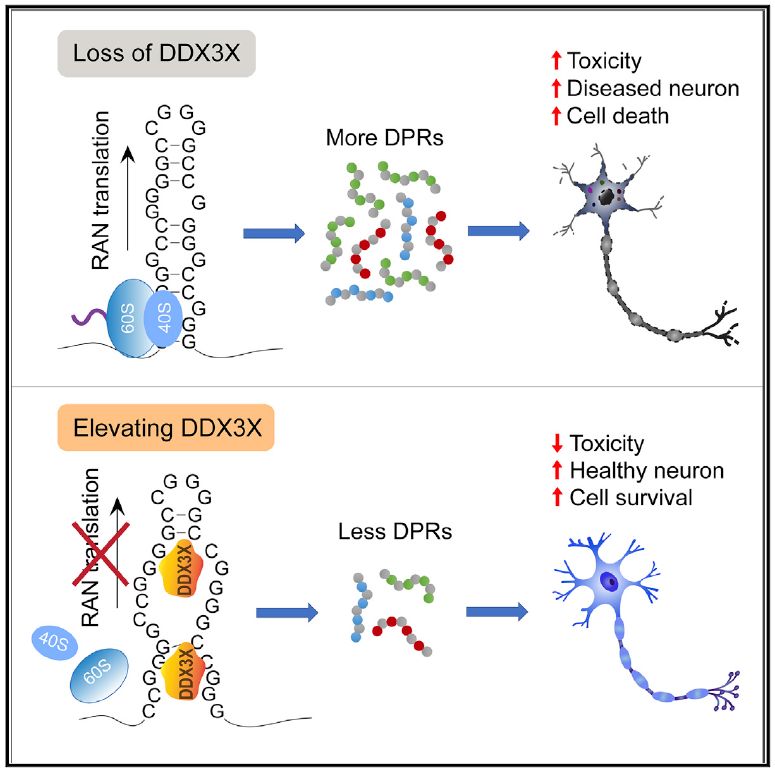
该研究通过CRISPR-Cas9人全基因组敲除筛选发现了众多可影响C9ORF72 (GGGGCC)n RAN翻译产物的基因,这些基因多与RNA的出核转运、蛋白翻译及蛋白酶体介导的蛋白降解等功能相关。研究人员明确了(GGGGCC)n RNA分子是由NXT1-NXF1通路从胞核转运至胞浆进行蛋白翻译;并发现了DDX3X蛋白,一种RNA解螺旋酶,可与 (GGGGCC)n RNA分子特异性结合,影响RNA二级结构,从而进一步抑制C9ORF72 (GGGGCC)n RAN翻译的发生,减少毒性DPRs(poly-GA,poly-GP和poly-GR)的产生;而且这一调控机制依赖于DDX3X蛋白的解螺旋酶活性。
研究人员发现敲除DDX3X蛋白可特异性加强C9ORF72 (GGGGCC)n果蝇模型中(GGGGCC)n重复序列扩增对果蝇眼盘表型的毒性,且可通过过表达果蝇的DDX3X同源蛋白Bel对其挽救。DDX3X敲除还可显著增加C9ORF72-ALS/FTD患者淋巴母细胞及诱导多能干细胞iPSCs多聚甘氨酸-脯氨酸(poly-GP)DPR的水平。而当在分化的神经元细胞(iPS-Neuron)中过表达DDX3X蛋白时,poly-GP水平下降。该研究还发现DDX3X蛋白可逆转 C9ORF72 (GGGGCC)n重复序列异常扩增对神经元细胞核转运功能的损伤,并增加神经元细胞对谷氨酸毒性的耐受。
综上,本研究揭露了DDX3X作为一种RNA解螺旋酶是C9ORF72 (GGGGCC)n RAN翻译的重要调控蛋白,并提示可以DDX3X为治疗靶点延缓C9ORF72-ALS/FTD患者的神经元死亡。该研究还证实了CRISPR-Cas9文库筛选技术在神经退行性疾病机制研究中的重要意义。
原文链接:
https://doi.org/10.1016/j.neuron.2019.09.003
参考文献
1. H. Paulson, Repeat expansion diseases. Handb Clin Neurol 147, 105-123 (2018).
2. S. C. Ling, M. Polymenidou, D. W. Cleveland, Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron 79, 416-438 (2013).
3. M. DeJesus-Hernandez et al., Expanded GGGGCC hexanucleotide repeat in noncoding region of C9ORF72 causes chromosome 9p-linked FTD and ALS. Neuron 72, 245-256 (2011).
4. A. E. Renton et al., A hexanucleotide repeat expansion in C9ORF72 is the cause of chromosome 9p21-linked ALS-FTD. Neuron 72, 257-268 (2011).
5. B. D. Freibaum, J. P. Taylor, The Role of Dipeptide Repeats in C9ORF72-Related ALS-FTD. Front Mol Neurosci 10, 35 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476774&idx=3&sn=59468c242c92c05b927b9e1c662c2bb6&chksm=84e206d2b3958fc4325e7d86ee4fb244684762ac64d686df32370dcf011978b8d687568fba93&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn