科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-26
来源:生物探索
遗传性视网膜疾病(IRD)是由250多种不同基因的突变引起的一组致盲性疾病。Leber氏先天性黑蒙症(LCA)是IRD最常见的一种,多数LCA患者在整个儿童时期都会有严重的视力障碍,随着视网膜的进行性变性,中年时则会完全失明。目前尚无高效的治疗选择。
2017年,美国食品药品监督管理局(FDA)批准了第一种针对RPE基因中具有双等位基因突变的LCA患者的基因疗法,即使用腺相关病毒(AAV)将正确的RPE65基因传递到视网膜中行使功能。临床试验表明,治疗第一年视觉功能有所改善,但长期效果会下降。研究人员猜测这可能是由于AAV载体的递送的转基因表达水平随时间下降了,或者RPE65蛋白缺乏引起的视网膜变性对外源表达的RPE65蛋白产生了抵抗力。
2020年10月19日,来自美国加利福尼亚大学和凯斯西储大学的研究团队在《Nature Biomedical Engineering》上发表了题为Restorationof visual function in adult mice with an inherited retinal disease via adeninebase editing的研究成果,其利用腺嘌呤碱基编辑器(ABE),克服了CRISPR-Cas9系统的脱靶突变、低编辑效率等障碍,成功纠正基因突变,恢复了患有遗传性视网膜疾病的成年小鼠的视觉功能。

DOI: 10.1038/s41551-020-00632-6
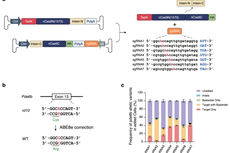
研究人员以RPE65基因的3号外显子上发生单碱基突变,导致该可再生11-顺式视黄醛和视色素的蛋白无法表达的rd12小鼠作为LCA临床相关模型进行研究。其首先在体外细胞中评估了以同源重组修复(HDR)的方式实现对突变位点的修复,结果发现HDR的效率仅为0.03%,不能恢复RPE65的功能和改善疾病表型。
之后,研究人员尝试向视网膜下递送ABE,通过将RPE65基因互补链上的A转换为G的方式,以更高的精度和最小的脱靶率来纠正该病理突变。其设计出密码子优化后的带有sgRNA-A5,sgRNA-A6的ABE变体(ABEmax),并通过rd12细胞系验证了ABE的密码子优化可以产生更稳定和更高的蛋白表达,ABEmax具有更强的碱基编辑效率,可以最小的脱靶率纠正无义突变。
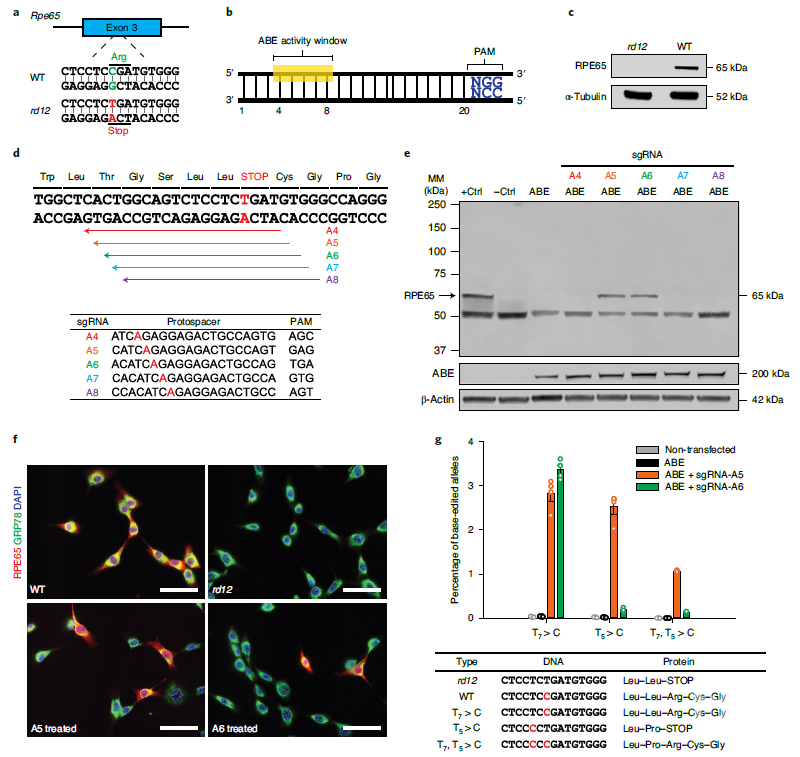
体外验证ABE对Rpe65突变校正率
然后研究人员生产了三种慢病毒载体,将sgRNA和ABEmax通过注射递送至小鼠视网膜的色素上皮层(RPE)组织进行表达,以评估该碱基编辑方法的功效。注射五周后,研究人员通过蛋白质免疫印迹法检测了处理和对照小鼠眼中RPE65蛋白的恢复情况。结果发现,带有sgRNA-A5,sgRNA-A6的ABEmax的处理使小鼠成功表达了定位正确的RPE65蛋白。对每只眼睛的矫正细胞百分比进行分析,发现A5和A6处理分别矫正了32%和17%的细胞。
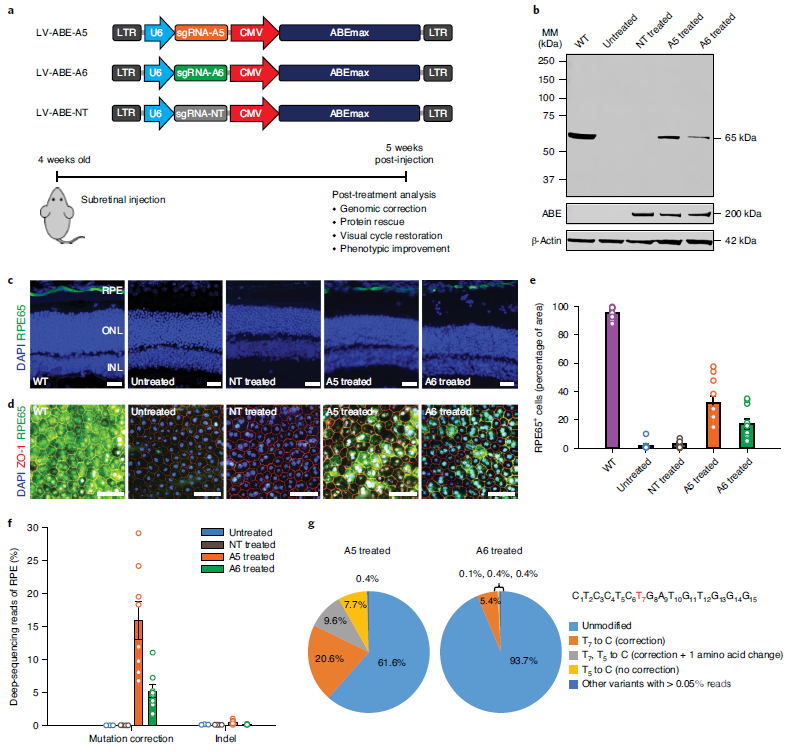
视网膜下递送ABE可以纠正rd12小鼠的突变,恢复RPE65的表达
为了进一步量化其矫正效率,研究人员对小鼠RPE组织中分离的DNA进行了高通量测序。结果表明,sgRNA-A5的ABEmax处理的最大矫正率可高达29%,sgRNA-A6的ABEmax最大矫正率可达11%。通过染色体外环状DNA测序(CIRCLE- seq)对sgRNA-A5和A6的脱靶活性进行评估,结果并未检测到对照RPE组织的背景水平以上的脱靶编辑。
然后研究人员检测了矫正效率更高的A5处理的rd12小鼠是否可以恢复功能性视觉循环,以进一步评估碱基编辑的治疗效果。结果发现,经A5处理的rd12小鼠眼睛在完全黑暗适应后显示出11-顺式视黄醛的大量生成,视觉周期得以恢复,且新生成的11-顺式视黄醛可在闪光刺激后立即光异构化为全反式视黄醛,产生视觉。此外,该基因编辑处理的小鼠也被验证了可以恢复其视网膜细胞和视觉功能,从视网膜到初级视觉皮层的视觉通路的功能完整性以及皮层反应也得到了恢复。
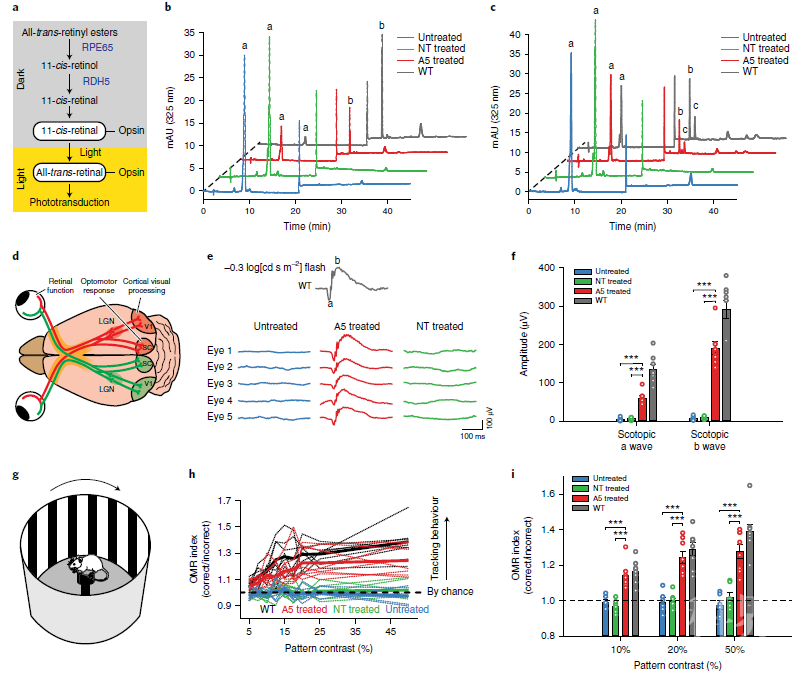
碱基编辑后rd12小鼠视觉周期和视网膜功能的恢复
该研究的通讯作者Krzysztof Palczewski表示:“在这项概念验证研究中,我们提供了基因编辑在矫正引起遗传性视网膜疾病的突变和恢复视觉功能方面的临床潜力的证据。在接受基因编辑治疗后,我们研究的小鼠可以根据方向,大小,对比度以及时空频率来区分视觉变化,这些结果非常令人鼓舞,这代表着遗传性视网膜疾病治疗方法的重大进步”。
参考资料:
[1] Restoration of visual function in adult mice with an inherited retinal disease via adenine base editing.
来源:biodiscover 生物探索
原文链接:https://mp.weixin.qq.com/s?__biz=MzU2MTQ2MDE0Ng==&mid=2247520614&idx=2&sn=f498ab8ca1540d3d5bc8927541472513&chksm=fc7ab7bbcb0d3eada3a7c0fb6edec99c738a728e627357c515d4517486e3ac50819bccc130a2#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
糖尿病视网膜病变检查
基因编辑视网膜感光细胞治疗遗传性致盲疾病研究获进展

在中国,几千万人眼睛里埋伏着一个定时炸弹
Sci Adv | 薛天/仇子龙/章梅合作实现在体精准基因治疗和视觉修复
天津工生所等在基因编辑治疗遗传性视网膜疾病方面获进展
糖尿病视网膜病变检查
眼睛出现这种情况,可能是帕金森病的早期征兆?
基因治疗让失明小鼠重见光明


【大师讲堂】视网膜的起源及演化历程
“暗夜猎手”古代蜘蛛,眼睛像猫一样能反光