科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-14
来源:宏基因组
微生物群落胞内/胞外吸附/胞外游离水环境DNA的分离提取Isolation and Extraction of Intracellular, Absorbed-extracellular and Free-extracellular Environmental DNA from Aquatic Microbial Community赵泽,鞠峰*1 浙江省海岸带环境与资源研究重点实验室,工学院,西湖大学,杭州,浙江;2 前沿技术研究所,浙江西湖高等研究院,杭州,浙江。*通讯作者邮箱: jufeng@westlake.edu.cn 摘要:胞外DNA是位于微生物细胞膜外的DNA片段,来自于微生物的主动/被动排放或细胞裂解,作为微菌落的结构成分发挥着重要的作用。本实验流程通过过滤、洗脱再过滤的二级处理将环境水体中微生物组的胞内/胞外吸附/胞外游离DNA分离,并且在十六烷基三甲基溴化铵(CTAB)提取DNA的方法上进行优化,实现大体积水样中微量胞外游离/胞外吸附DNA的分离提取,并且适用于不同类型环境样品。该方案得到的胞内/胞外吸附/胞外游离DNA可用于下游的PCR、qPCR、标记基因扩增子测序、宏基因组测序等相关分析。胞内DNA适用于探究微生物群落结构与功能;胞外吸附/胞外游离环境DNA (eDNA) 适用于水环境生物多样性评估、生物入侵预警与防治以及濒危物种保护。关键词: 胞外游离DNA,胞外吸附DNA,胞内DNA,CTAB材料与试剂材料:1.15 ml离心管 (CORNING, CentriStar, catalog number: 430790)2.50 ml离心管 (CORNING, CentriStar, catalog number: 430828)3.1.5 ml离心管 (AXYGEN, catalog number: MCT-200-C)4.2 ml离心管 (AXYGEN, catalog number: MCT-150-C)5.0.2 μm聚碳酸酯微孔滤膜 (Millipore, Isopore, PC Membrane, 47mm, catalog number: GTTP04700)试剂:1.CTAB (Solarbio, catalog number: C8440)2.Tris (Solarbio, Ultra Pure Grade, catalog number: T8060)3.Tris-HCl (Sigma, BioUltra, for molecular biology, catalog number: 93363)4.EDTA (Solaibio, Biotechnolongy Grade, catalog number: E8030)5.苯酚-氯仿-异戊醇 (Solarbio, catalog number: P1012-100)6.氯仿-异戊醇 (Solarbio, catalog number: P1014-100)7.异丙醇 (Acros, catalog number: 447080010)8.氯化钠 (Sigma, for molecular biology, catalog number: S3014)9.氢氧化钠 (Sigma, catalog number: 71687)10.PBS缓冲液 (Thermo Fisher, catalog number: C10010500BT)11.无水乙醇 (Sigma)12.FastDNA Spin Kit for Soil (Qiagen)13.UltraPure DNase/RNase-Free Distilled Water (Thermo, catalog number: 10977023)14.Qubit检测试剂 (Thermo)15.CTAB提取液 (pH 8.0) (见溶液配方)16.高盐TE buffer (pH 8.0) (见溶液配方)17.TE buffer (pH 8.0) (见溶液配方)18.Tris-HCl-EDTA提取液 (pH 8.0) (见溶液配方)19.苯酚-氯仿-异戊醇 (见溶液配方)20.氯仿-异戊醇 (见溶液配方)仪器设备1.剪刀2.镊子3.真空过滤器 (台湾洛科六联过滤器,MultiVac610-MS)4.真空泵 (GAST, DOA-P504-BN)5.移液枪 (Eppendorf, 0.5-10 μl, 2-20 μl, 10-100 μl, 20-200 μl, 100-1000 μl, 0.5-5 ml)6.移液吸头 (QSP, 10 μl, 20 μl, 100 μl, 200 μl, 1000 μl, 5 ml)7.高速冷冻离心机 (Eppendorf, Centrifuge 5810R)8.桌面冷冻离心机 (Eppendorf, Centrifuge 5427R)9.涡旋仪 (IKA, VORTEX2)10.冰箱 (4 °C, -20 °C)11.水浴锅12.冰盒13.NanoDropTM One/OneC (Thermo)14.Qubit 4 (Thermo)15.核酸电泳仪(上海天能,HE120+HE90+EPS300+VE-180)16.紫外凝胶成像系统(上海天能,TON-2500)实验步骤1.环境水样采集环境水样采集后应尽快低温(冰袋,保温箱)运输至实验室并储存在4 °C冰箱中。注:建议在水样采集后24小时内完成后续水样预处理和DNA分离提取。2.环境水样预处理2.1环境水样经0.2 μm滤膜过滤,滤膜于4 °C储存用于后续胞内DNA和胞外吸附DNA的分离,滤液用于后续胞外游离DNA的提取。注:不同环境水体中胞外DNA的含量不同。河流、湖泊、近岸海水等环境水体建议过滤水样1 L及以上,远海海水等较为洁净的环境水体需增加过滤水样体积。不同环境水体样品建议通过预实验确定合适的过滤体积,以保证提取得到的DNA满足下游实验要求。2.2准备洁净的50 ml离心管,用灭菌剪刀将步骤2.1中所得滤膜剪碎并转移到50 ml离心管中,加入10 ml PBS缓冲液,室温涡旋20 min,溶液经新的0.2 μm滤膜过滤。所得滤膜用于胞内DNA的提取,所得滤液用于胞外吸附DNA的提取。注:环境水样预处理后用于胞内DNA提取的滤膜可放置于-20 °C保存直至提取。用于胞外吸附/游离DNA提取的滤液建议12小时内完成提取,不宜长时间放置。3.水样胞外游离DNA的提取注:DNA提取实验开始前将异丙醇和乙醇放置在4 ℃冰箱中预冷。3.1.准备15个洁净的50 ml离心管,在每个离心管中加入步骤2.1 中所得滤液20 ml,加入等体积的CTAB提取液,充分颠倒混匀。65 °C水浴30 min。然后于4 °C、10,000 × g下离心10 min,弃掉上清液。(Zhao 等, 2020; Mao等, 2014; Zhang 等, 2018)注:不同环境水体中胞外游离DNA的含量不同,甚至同一环境水体部分采样点之间含量差别也较大。建议通过预实验确定不同环境水体需要处理滤液的合适体积,以保证所得DNA满足下游实验需求。我们的实验结果表明,300 ml湖泊水体滤液提取得到约100-200 ng胞外游离DNA。3.2.所得沉淀用300 μl高盐TE buffer重悬,将所有50 ml离心管中的悬浊液全部转移至15 ml无菌离心管中。3.3.向离心管中加入0.6体积的冷异丙醇,水样于冰上放置1 h,然后在10,000 × g、4 °C下离心15 min,弃掉上清液。3.4.所得沉淀用450 μl Tris-HCl-EDTA提取液重悬,向重悬液中加入等体积的苯酚-氯仿-异戊醇,上下颠倒混匀,于13,000 × g、4 °C离心10 min。3.5.取上清液置于新的2 ml无菌离心管中,重复上述操作一次。3.6.用移液枪尽可能吸取上清液,加入等体积的氯仿-异戊醇混合,相同条件下离心。3.7.取上清液置于新的2 ml无菌离心管中,加入氯化钠 (终浓度为0.2 M) 和冷乙醇 (终体积为70%) 沉降DNA,-20 °C下放置1 h。然后于13,000 × g、4 °C离心15 min,弃掉上清液。3.8.所得沉淀加入0.5 ml 70%冷乙醇,颠倒混匀,于13,000 × g、4 °C离心5 min,弃掉上清液。3.9.重复上述操作一次。3.10.将离心管于室温放置5~10 min风干沉淀,用50 μl 65 °C预热的TE buffer溶解沉淀。4.水样胞外吸附DNA的分离提取按照水样胞外游离DNA的提取实验步骤从2.2所得滤液中提取胞外吸附DNA。5.水样胞内DNA的分离提取取步骤2.2中过滤所得滤膜,按照DNA提取试剂盒 (FastDNA Spin Kit for Soil) 的说明书提取胞内DNA。6.DNA的浓度检测用NanoDropTM One/OneC超微量核酸蛋白定量仪检测胞内/胞外吸附/胞外游离DNA的浓度和纯度, 进一步采用Qubit 4荧光剂精准检测DNA浓度。7.DNA的质量检测用1%的琼脂糖凝胶电泳检测DNA的质量,在紫外凝胶成像仪上需观察到清晰的目标DNA条带。8.DNA样品的储存与下游分析通过上述步骤获取的DNA样品可储于-20 °C,或直接用于后续的PCR、qPCR、扩增子测序、宏基因组测序等相关分析。失败经验1.选用洁净的材料和试剂,严格无菌操作胞外DNA (特别是胞外游离DNA) 在环境水体中含量较低,在提取过程中要严格无菌操作,选用无菌、无核酸酶的高纯试剂和材料,从而避免提取过程造成的胞外DNA的污染和降解。2.重复提取积累经验由于胞外DNA的含量较低,使用该方法提取的过程中经常不能直接观察到DNA沉淀的存在,需要明确离心沉淀后沉淀附着的位置,通过反复提取熟练提取流程,优化提取操作,前几次的提取失败是较为正常的结果。注:对于50 ml和15 ml离心管,建议将离心管标签区域背向轴心放置(图1A),对于1.5 ml离心管,建议将管盖连接处背向轴心放置(图1C),离心管沉淀附着位置见沉淀模拟示意图(图1B)。图1:A. 50 ml离心管放置示意图;B. 50 ml离心管沉淀模拟示意图;C. 1.5 ml离心管放置示意图3.合理规划实验时间此方法提取胞外DNA所需时间较长 (8 h以上的时间),实验开始前请做好相关准备工作,合理规划实验时间,避免由于时间问题中断实验。4.空白对照设置由于胞外DNA (特别是胞外游离DNA) 在环境水样中含量较低,在DNA分离提取过程中可能会存在的微量微生物污染会对实验结果产生影响,所以建议在DNA分离提取过程中设置空白对照以检测是否存在污染问题。建议可以用UltraPure DNase/RNase-Free Distilled Water替代环境水样作为空白对照组,进行DNA分离提取全流程操作。空白对照组提取DNA后,进行DNA浓度检测DNA浓度应为零,进行琼脂糖凝胶电泳检测应无条带出现,以排除分离提取操作中污染的发生。溶液配方1.CTAB提取液 (pH 8.0)50 mM Tris10 mM EDTA1% CTAB2.高盐TE buffer (pH 8.0)10 mM Tris-HCl0.1 mM EDTA1 M NaCl3.TE buffer (pH 8.0)10 mM Tris-HCl0.1 mM EDTA4.Tris-HCl-EDTA提取液 (pH 8.0)10 mM Tris-HCl0.1 mM EDTA5.苯酚-氯仿-异戊醇25:24:1, vol/vol/vol (可购买成品试剂)6.氯仿-异戊醇24:1, vol/vol/vol (可购买成品试剂)致谢本实验得到国家自然科学基金青年基金 (51908467)的资助。感谢西湖大学环境微生物组和生物技术实验室的全体成员的建议和帮助。感谢天津大学近海环境安全实验室的全体成员的建议和帮助。

来源:meta-genome 宏基因组
原文链接:http://mp.weixin.qq.com/s?__biz=MzUzMjA4Njc1MA==&mid=2247493831&idx=1&sn=7d54fa3e4da579077bc51f1729a831f2
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
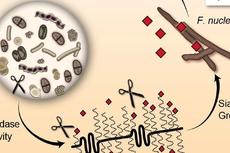
口腔微生物会破坏阴道微生物平衡
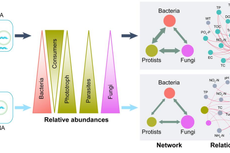
城市环境所在河流水库水体中微生物残体DNA干扰微生物多样性方面获进展
微生物测量
合成生物学: 一个用来控制转基因生物的内置毁灭开关
微生物学: 生命早期的抗生素使用可能会影响发育

微生物所建立无痕迭代DNA组装新方法
空气微生物检测

微生物组科技
疾病: 了解风湿性关节炎的发病机制
科普:夫妻相真的与细菌有关吗?


