科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
化合物引入氰甲基的过程称为氰甲基化,反应结果得到烷基乙腈。最简单有效的方法就是利用相应的烷基氰化物进行相应的 C-H键活化进而发生偶联反应。也可以通过使三甲基硅基乙腈 (TMSCH2CN) 脱掉三甲基硅基(TMS) 后进行有关反应,也可以用 α-氰基乙酸 (HOOCCH2CN)通过脱羧反应得到氰甲基活泼中间体,另外 4-异恶唑硼酸频哪醇酯也可作为氰甲基的来源。
定义化合物引入氰甲基的过程称为氰甲基化,反应结果得到烷基乙腈。最简单有效的方法就是利用相应的烷基氰化物进行相应的 C-H键活化进而发生偶联反应1。也可以通过使三甲基硅基乙腈 (TMSCH2CN) 脱掉三甲基硅基 (TMS) 后进行有关反应,也可以用 α-氰基乙酸 (HOOCCH2CN)通过脱羧反应得到氰甲基活泼中间体,另外 4-异恶唑硼酸频哪醇酯也可作为氰甲基的来源2。
乙腈的加成反应早在 1999 年,美国爱荷华州立大学 (Iowa State University) 的 Verkade 教授研究小组报道了首例碱催化的 β-羟基氰化合物的合成。催化剂 A12 是一种非离子型强碱。报道称,体系中硫酸镁作为路易斯酸,起到活化羰基的作用。反应在室温下进行,产物 β-羟基氰的收率较高;且并未在反应中观察到脱水产物的生成;遗憾的是,这一体系的高效不对称合成还尚无报道3。
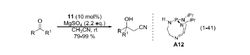
2003 年,日本东京大学 (The University of Tokyo) 的 Shibashaki 教授课题组报道了铜盐催化的反应体系,如式 (1-42)。报道称,叔丁醇亚铜盐作为路易斯酸,通过和氰基配位作用活化了乙腈的 C-H 键,降低了乙腈的 pKa值;叔丁氧负离子起到脱质子的作用4。

此后,Shibashaki 等在 2004 年报道了阳离子钌络合物作为催化剂的反应体系。在钌络合物、DBU(一种二氮杂双环的有机碱)、六氟磷酸钠的共催化下,使得芳基醛,脂肪醛和活泼亚胺和乙腈发生 Aldol 反应,以高收率获得 β-羟基,β-氨基氰产物。报道称,较大的同位素效应表明乙腈的去质子化是该反应的决速步;六氟磷酸钠的加入抑制了 DBU 和钌的配位,这正是催化量碱就能使反应完成的原因5。

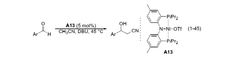
2005 年,美国布兰迪斯大学 (Brandeis University) 的 Ozerov 等报道了一例以镍螯合物为催化剂 (A13) 的反应体系。贫电子芳香醛和中性芳香醛底物的反应产率较高,而富电子芳香醛的反应效果不好。同位素效应表明决速步发生在C-C 键形成之前6。
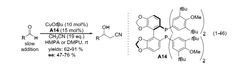
同样是 2005 年,在之前的研究基础之上 Shibashaki 课题组报道了首例乙腈对醛类化合物的不对称加成反应。体系以叔丁醇亚铜为催化剂,以具有轴手性的双膦配体 (A14) 进行不对称诱导,产物收率较好,但对映选择性中等7。
2008 年,日本名古屋大学 (Nagoya University) 的 Saito 教授研究小组报道了过渡金属铑催化的 Aldol 型反应。体系以一价铑络合物为催化剂,三环己基膦为配体;报道中未给出反应的机理。底物兼容性较好,芳香醛、杂芳香醛、α,β-不饱和醛、烷基醛等都能很好地和乙腈发生反应8。

乙腈的偶联反应1990 年,美国南卫理公会大学 (Southern Methodist University) 的 E. R. Biehl等报道了强碱作用下的芳基溴化物和乙腈发生的交叉偶联反应。但该反应经历了苯炔中间体,产生了区域选择性问题,加之会发生与溶剂,强碱试剂的偶联副反应,使得相应的氰烷基化产物收率普遍较低9。
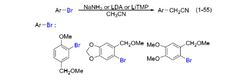
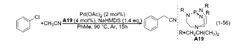
2003 年,美国爱荷华州立大学 (Iowa State Universuty) 的 Verkade 小组报道了芳基氯代物和乙腈发生的偶联反应,如式(1-56)。乙腈的用量为 1.2 当量,在催化量醋酸钯、商业可得的配体 A19 及双(三甲基硅基)氨基钠 (NaHMDS) 的共同作用下,以 50%的产率获得偶联产物氰化苄;此外,还以 20%的产率获得二苯基乙腈。若将乙腈的用量提高至 2 当量,氰化苄的收率为 70%,二苯基乙腈的产率为 10%。
此前 2002 年,当时还在耶鲁大学 (Yale University) 开展研究工作的 Hartwig教授课题组报道过溴代苯和乙腈在钯盐催化作用下的反应。但在其发展的体系下,仅获得二苯基乙腈而未发现单芳基化的氰化苄10。
实际上早在 2011 年,中国科学院上海有机化学研究所的刘国生研究员课题组就报道了和式 (1-52) 相同的反应。体系以醋酸钯/2,2’-联嘧啶 (A20) 为催化剂,在高碘试剂二特戊酸碘苯和氟化银共同作用下,实现了两步串联反应。报道称,苯基邻位上的 C-H 键首先发生活化,和烯烃一端的碳发生偶联反应;烯烃的另一端碳再和乙腈发生偶联反应,如图 (1-7)。即他们提出了和式 (1-52) 反应完全不一样的反应路径,故在此将其列入偶联反应一类作出介绍。
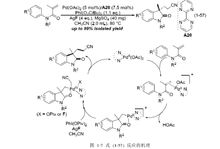
上述反应中,当底物 R2基团为乙酰基或对甲苯磺酰基等吸电子基团时,反应不进行;若底物羰基 α 位置上的 sp2碳上没有取代基,反应也不能进行;另外,同位素效应表明乙腈的 C-H 键活化是整个反应的决速步11。
本词条内容贡献者为:
李晓林 - 教授 - 西南大学