科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-23
来源:BioArt植物
真核细胞内蛋白质的降解主要通过自噬(autophagy)和泛素-蛋白酶体系统(ubiquitin-proteasome system)两种途径发生。在泛素-蛋白酶体负责的蛋白降解过程中,一系列泛素酶的级联反应为底物蛋白作上泛素标记,使其能够被蛋白酶体识别并降解。其中,最重要的泛素连接酶E3为蛋白降解反应赋予了特异性,在人体中表达超过600种的E3蛋白通过与底物蛋白的相关结构域进行选择从而在不同场景下降解指定的蛋白。在对泛素-蛋白酶体系统的这一反应特异性的探索过程中,人们发现了一条重要的规律,被称作“N端规则”(N-end rule),即蛋白质的半衰期取决于其N端的氨基酸残基的种类和特性;具有这类性质的N端残基被赋予“N端降解子”(N-terminal degron)的名称。尽管由N端规则支配的蛋白降解和质控途径对于包括细胞凋亡、线粒体状态、癌症发生等多类生物过程均具有相当重要的影响,且对于细胞工程利用蛋白降解系统具有显著意义,人们迄今为止还未掌握N端规则的全貌,尤其是N端降解子和E3泛素酶和互作特异性形成机制。
来自美国哈佛医学院(Harvard Medical School)的研究人员在Science上发表了题为A glycine-specific N-degron pathway mediates the quality control of protein N-myristoylation的长文,对蛋白降解N端规则进行了全面而细致的解剖。 在该研究中,作者利用改造后的蛋白质稳定性全局报告质粒系统(Global Protein Stability, GPS)构建了一个具有数万种人类蛋白质N端序列的由GFP和DsRed双荧光表征的蛋白质稳定性筛选库。这一强大的系统能够为每一个N端序列都赋予一个指数,代表其通过N端规则对蛋白降解效率的影响程度。在此基础上,作者通过比较同一组氨基酸残基处于近N端时和处于中间部分时对应的蛋白稳定指数,发现甘氨酸(glycine)、赖氨酸(lysine)、精氨酸(arginine)和半胱氨酸(cysteine)对蛋白不稳定性的促进作用最强。另外,利用一系列基因敲除和筛选手段,作者发现了一条新的由Cullin蛋白家族中的ZYG11B和ZER1所介导的独立于UBR蛋白的甘氨酸作为N端降解子的蛋白降解途径。最后,作者还展示了这一途径的两点生物学意义:一是在细胞内重要的翻译后修饰——豆蔻酰化(myristoylation)失效时,原本被保护的蛋白N端甘氨酸残基暴露在外,使蛋白受到ZYG11B和ZER1泛素酶的攻击而稳定性大大降低;二是作为强效N端降解子的甘氨酸残基在凋亡过程中由半胱天冬酶(caspase)介导产生的反应物中显著富集,而实验也证明上述两种甘氨酸降解子特异泛素酶能够高效率地降解凋亡产物。
在该研究中,作者利用改造后的蛋白质稳定性全局报告质粒系统(Global Protein Stability, GPS)构建了一个具有数万种人类蛋白质N端序列的由GFP和DsRed双荧光表征的蛋白质稳定性筛选库。这一强大的系统能够为每一个N端序列都赋予一个指数,代表其通过N端规则对蛋白降解效率的影响程度。在此基础上,作者通过比较同一组氨基酸残基处于近N端时和处于中间部分时对应的蛋白稳定指数,发现甘氨酸(glycine)、赖氨酸(lysine)、精氨酸(arginine)和半胱氨酸(cysteine)对蛋白不稳定性的促进作用最强。另外,利用一系列基因敲除和筛选手段,作者发现了一条新的由Cullin蛋白家族中的ZYG11B和ZER1所介导的独立于UBR蛋白的甘氨酸作为N端降解子的蛋白降解途径。最后,作者还展示了这一途径的两点生物学意义:一是在细胞内重要的翻译后修饰——豆蔻酰化(myristoylation)失效时,原本被保护的蛋白N端甘氨酸残基暴露在外,使蛋白受到ZYG11B和ZER1泛素酶的攻击而稳定性大大降低;二是作为强效N端降解子的甘氨酸残基在凋亡过程中由半胱天冬酶(caspase)介导产生的反应物中显著富集,而实验也证明上述两种甘氨酸降解子特异泛素酶能够高效率地降解凋亡产物。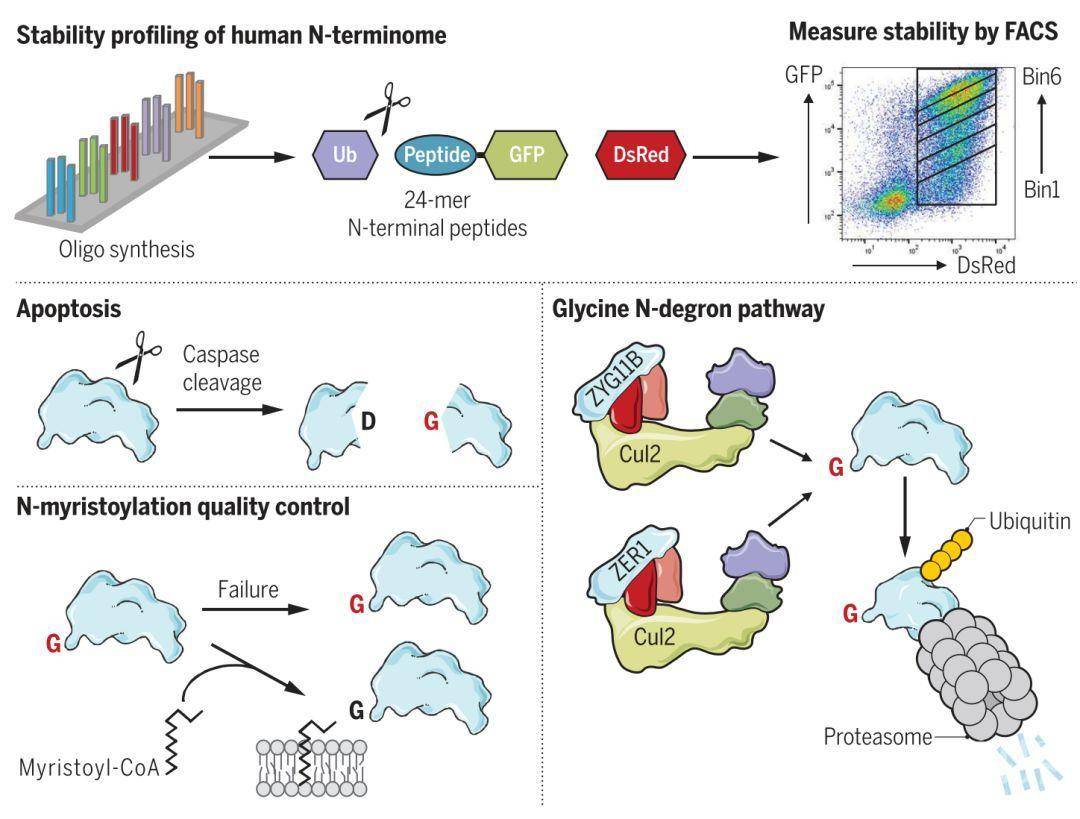 总之,该项研究系统性地从单氨基酸水平揭示了蛋白质降解领域中的重要法则——N端规则的具体内涵和决定因素,其发现的由两个非经典E3泛素酶介导的新N端降解途径及其对应的生物学意义丰富了人们对蛋白降解过程的认知,也对人们利用这一系统进行高效特异的生物工程设计提供了助力。
总之,该项研究系统性地从单氨基酸水平揭示了蛋白质降解领域中的重要法则——N端规则的具体内涵和决定因素,其发现的由两个非经典E3泛素酶介导的新N端降解途径及其对应的生物学意义丰富了人们对蛋白降解过程的认知,也对人们利用这一系统进行高效特异的生物工程设计提供了助力。
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247500390&idx=3&sn=b532f9cd4173caa84d696b6f99dfaa77
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
乙烯和蛋白降解的N端规则对拟南芥种子休眠的影响

科学家发现7种土霉素降解途径

线粒体蛋白易位相关的降解
Angew. Chem.:高效稳定的N 端半胱氨酸蛋白质定点修饰新突破
程序可控的新型高效蛋白靶向降解技术问世
王友军教授课题组在Nature子刊上发表文章阐述STIM1蛋白激活的分子机制

研究合成可用于肿瘤特异性蛋白降解和乳腺癌精准治疗的高分子蛋白降解剂

Science | 系统性揭示蛋白降解N端规则
胸腹水纤维蛋白降解产物
Mol Cell: 纳米抗体介导PROTACs蛋白靶向降解技术