科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-27
来源:中国科学院重大科技基础设施共享服务平台
2020年11月16日,国家蛋白质科学研究(上海)设施用户复旦大学生命科学学院董爱武团队与麻锦彪团队合作于 《美国科学院院刊》 (PNAS),在线发表了题为 “NAP1-Related Protein 1 (NRP1) has multiple interaction modes for chaperoning histones H2A-H2B” 的研究论文,揭示了组蛋白分子伴侣NRP1以多种方式识别组蛋白H2A-H2B的分子机制。
Nucleosome assembly protein 1 (NAP1)作为组蛋白H2A-H2B重要的分子伴侣,最早在非洲爪蟾的受精卵中被分离且具有核小体组装活性;随后在酵母、动物和植物中都发现了NAP1的同源蛋白,而且NAP1家族蛋白在进化过程中具有很强的保守性。NAP1-Related Protein 1(NRP1)是拟南芥NAP1家族成员,作为组蛋白H2A-H2B的分子伴侣参与核小体移除,并能与转录因子WER结合激活下游靶基因GL2,调控植物根毛发育。
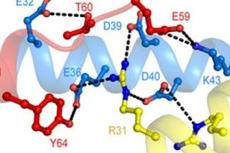
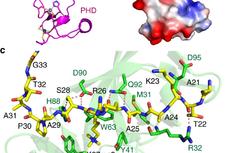
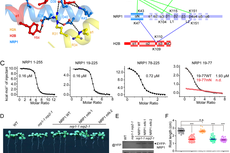
为了探索NRP1移除核小体的分子机制,董爱武团队和麻锦彪团队合作解析了NRP1与组蛋白H2A-H2B的复合物晶体结构(3.0 埃),发现NRP1的N端结构域可以直接结合H2A-H2B,这是NAP1家族蛋白没有被发现过的一种新的组蛋白结合方式。遗传互补实验表明:NRP1 N端识别H2A-H2B的关键氨基酸突变的蛋白质NRP1-mN不能回复NRP缺失突变体nrp1-1 nrp2-1的表型,证明NRP1 N端结构域与H2A-H2B的相互作用在体内具有重要的生理功能。该工作还解析了NRP1 C端酸性结构域和H2A-H2B的复合物晶体结构(1.65 埃),发现NRP1 C端的[D/E]-X/XX-D-[F/Y]基序在很多H2A-H2B结合蛋白中都存在并以保守的模式结合组蛋白,暗示[D/E]-X/XX-D-[F/Y]基序可以作为H2A-H2B结合蛋白的一个标志。此外,通过体外交联-质谱分析和ITC实验,进一步鉴定了NRP1 Earmuff结构域中参与H2A-H2B结合的关键氨基酸。最后,体外核小体组装与去组装实验证明:NRP1的N端结构域、Earmuff 结构以及C端酸性区域对NRP1发挥功能都是必须的。综上所述,该工作揭示了拟南芥NRP1识别组蛋白H2A-H2B的多种方式,阐明了NRP1介导核小体组装与去组装的结构基础。
2017年,董爱武团队与麻锦彪团队合作在 《植物细胞》 (The Plant Cell)发表了组蛋白分子伴侣NRP1与转录因子WER相互作用调控根毛发育的分子机制;2020年,董爱武团队与甘建华团队合作在 《核酸研究》 (Nucleic Acids Research)发表了WER识别DNA的分子基础;结合刚发表的NRP1识别组蛋白H2A-H2B的结构基础,较为完善地解析了组蛋白分子伴侣NRP1与转录因子相互作用,调控基因表达及植物发育的分子机制。
国家蛋白质科学研究(上海)设施BL18U1线站及BL19U1线站,上海光源BL17U1线站工作人员为其X射线晶体学衍射数据收集提供了及时有效的支持。
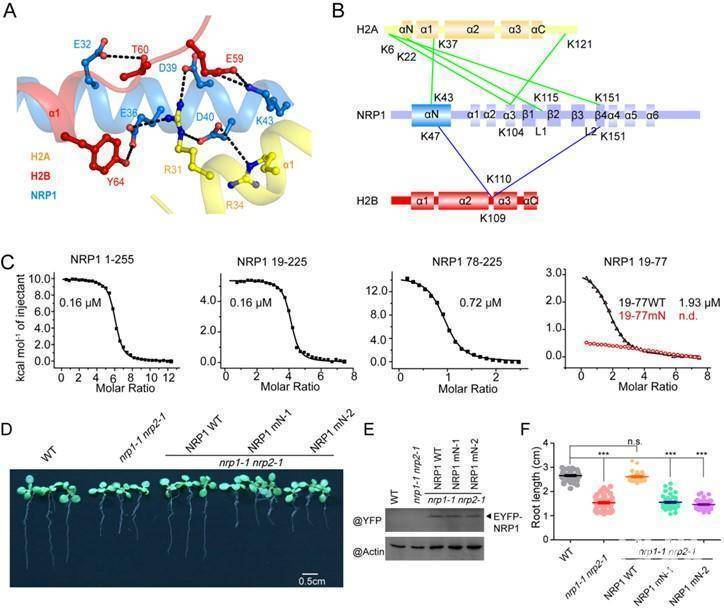
A. NRP1 N端识别H2A-H2B的关键氨基酸;B-C. 交联-质谱和ITC实验显示NRP1的N端和Earmuff 结构域均可结合H2A-H2B;D-F.遗传互补实验证明NRP1 N端结构域与H2A-H2B的相互作用在体内具有重要的生理功能。
(蛋白质设施上海提供)
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202011/t20201127_4559045.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Mol Cell | 北大罗建沅组揭示细胞应激调控新通路
科学家揭示亲代组蛋白遗传影响细胞分化命运
【前沿进展】复旦大学董爱武团队与麻锦彪团队合作揭示植物组蛋白分子伴侣识别组蛋白的结构基础
研究揭示SHL蛋白对抑制和活性组蛋白修饰的识别机制

NCB :组蛋白K-to-M突变助力表观遗传in vivo研究

人类早期胚胎发育组蛋白修饰重编程规律
PNAS | 复旦大学研究揭示植物组蛋白分子伴侣识别组蛋白的结构基础
我发现人类早期胚胎发育组蛋白重编程规律
耶鲁吴殿青组发现中性粒细胞极化新机制
董爱武/麻锦彪组合作揭示植物组蛋白分子伴侣识别组蛋白的结构基础