科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-14
来源:CBG资讯
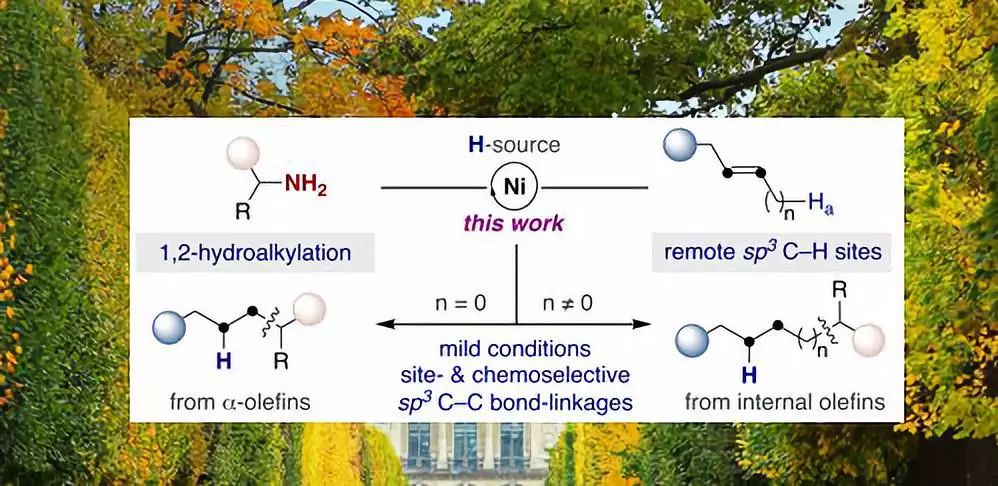
最近几年,通过非活化烯烃官能团化反应来形成C-C键的方法得到了蓬勃的发展。在这些方法中,通过金属氢物种对非活化烯烃的加成反应来形成亲核碳物种,随后与相应的亲电试剂反应来得到产物这一方式一直处于合成研究的前沿。
烷基胺结构广泛存在于药物及活性分子中,通过sp3 C-N键的断裂来实现新化学结构的构建是一种方便然而具有挑战性的工作。尽管这方面已得到了一系列进展,但这些方法仅限于使用有机金属试剂、有机卤代物或缺电的烯烃结构,而非活化烯烃甚至内烯仍旧是具有挑战性的结构。实现此类结构的转化不仅可以在方法学上实现前所未有的突破,而且将提供一种新的策略来构建复杂性分子。最近,西班牙加泰罗尼亚化学研究所Ruben Martin课题组成功实现了非活化烯烃的脱胺烷基化反应。该反应条件温和、底物范围广、化学选择性高,并具有位点选择性。对于端烯来说,反应具有反马氏选择性;对于内烯来说,可以通过链行走的方式实现远端sp3 C-H位点选择性。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.9b07489)。
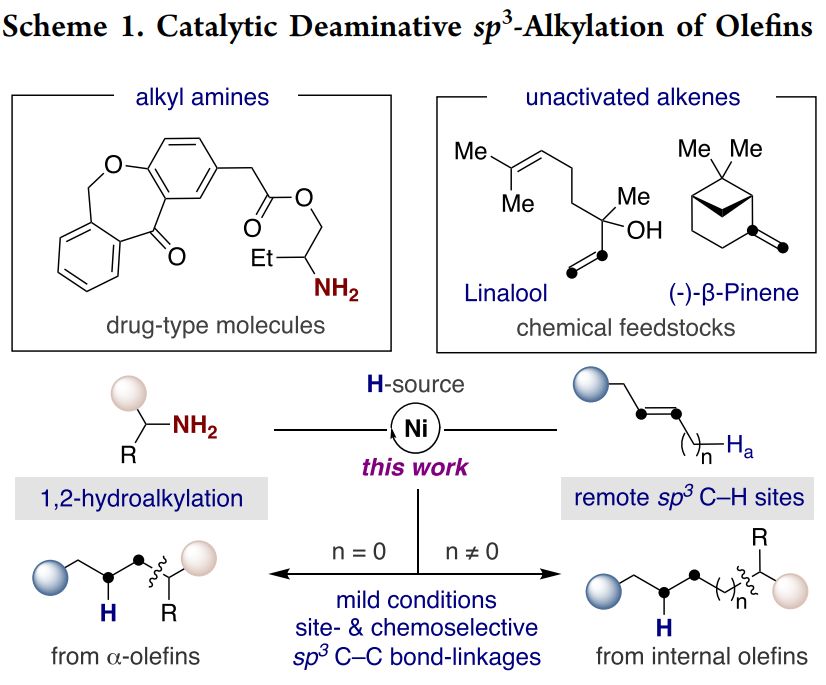
(来源:J. Am. Chem. Soc.)
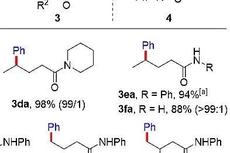
作者首先采用吡啶盐1a为模板底物进行条件优化(Table 1),通过对镍源、配体、氢负来源、无机碱和溶剂等反应条件的优化,确定了反应的最优反应条件为:10 mol% NiBr2·glyme为镍源、15 mol% L4为配体、(EtO)2MeSiH为硅氢来源、Na2HPO4为无机碱,底物在N-甲基吡咯烷酮/二氧六环混合溶剂中40 ℃反应14 h,最终以80%的分离收率得到目标产物,反应具有反马氏选择性。
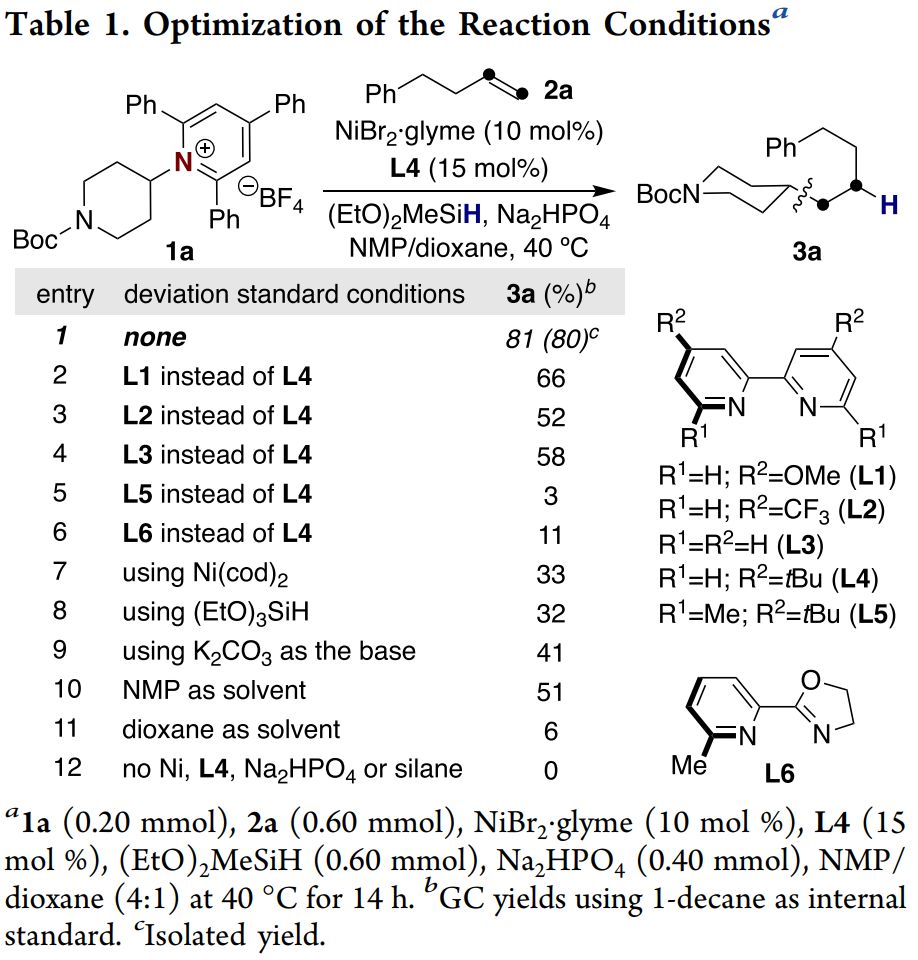
(来源:J. Am. Chem. Soc.)
确定最优反应条件后,作者随后对反应的底物范围进行了扩展(Table 2)。反应具有良好的官能团耐受性,氰基、酯基、氨基甲酸酯、硅基醚、酮类结构等均能兼容反应条件。值得一提的是,有机硼化合物、烷基卤代物及芳基卤代物均能参与到反应中,为后续的进一步衍生化提供了条件。另外,自由羟基也不会影响反应的进行,反应放大到2 mmol后仍能平稳进行。此外,具有位阻的1,1-二取代烯烃也是合适的底物,环状或非环状胺均能得到目标产物。
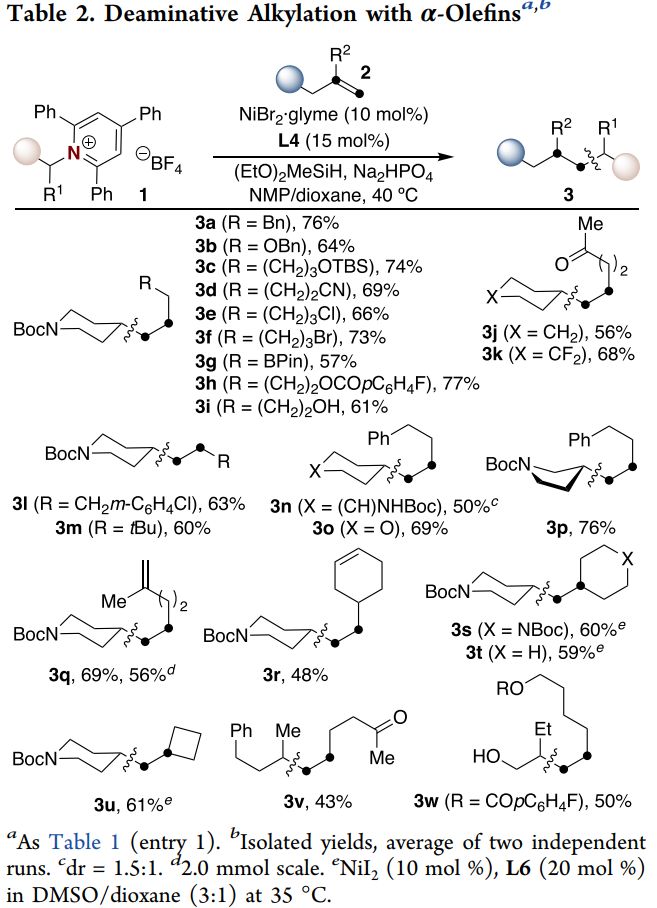
(来源:J. Am. Chem. Soc.)
随后,作者设想把底物范围进一步扩展到非活化内烯结构(Table 3)。内烯参与到反应中具有以下难点:1)非活化内烯对金属反应中心配位困难;2)区分内烯的两端烷基比较困难,区域选择性难以控制。经条件的进一步调整后,作者以57%的收率得到了内烯迁移后的脱胺烷基化产物,而且具有>36:1的选择性。反应兼容硅基醚、醛、杂环等结构。无论双键在哪个位置,即使是具有支链的烯烃或者三取代的烯烃,均能得到端位的产物。
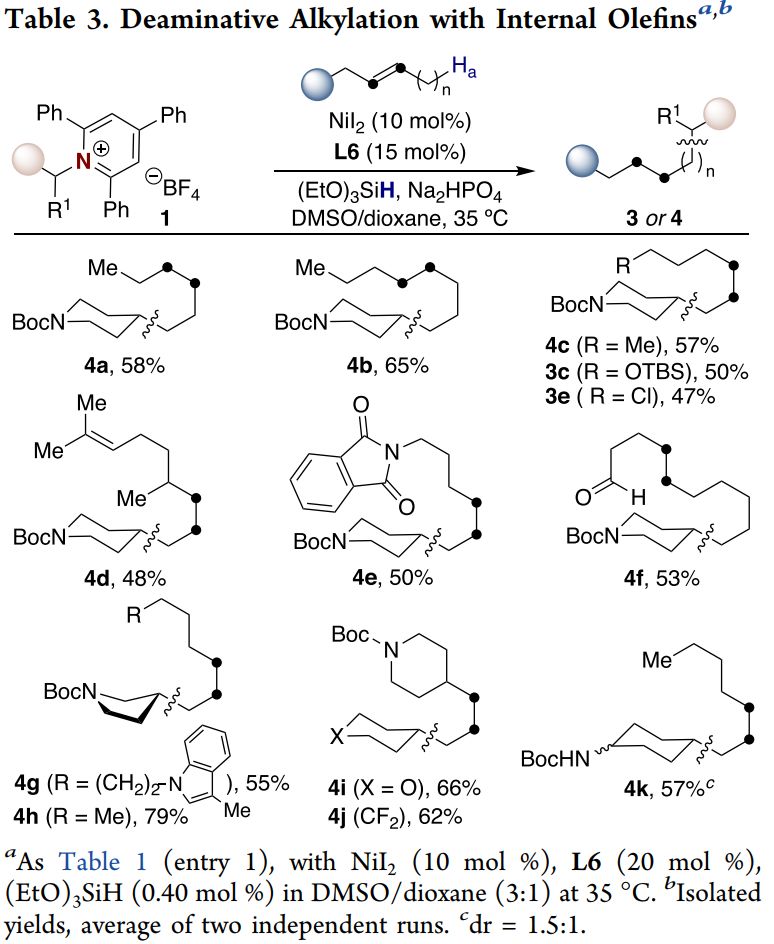
(来源:J. Am. Chem. Soc.)
随后,作者利用这一温和条件实现了复杂底物的后期修饰,反应具有中等到良好的收率及良好的官能团耐受性。反应可经一锅法进行,无需分离吡啶盐中间体。乙烯这一大宗化学品也能以61%的收率得到产物。这些后期研究进一步说明了该反应的应用价值。
小结:Ruben Martin课题组发展了非活化烯烃的催化脱胺烷基化反应。该反应条件温和、底物范围广、选择性高,并可用于复杂产物的后期修饰,为烯烃官能团化及sp3-sp3键活化的方式提供了一种很好的参考。
来源:BeanGoNews CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247497578&idx=2&sn=b0d8eec25d87cebe3750ecf49a2e206e&chksm=ec3cf623db4b7f3589e496fac8aa439c1908229ad782dab5d95ff7c7082dd39deededd493fb4&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
钯催化烯烃的不对称叠氮化反应
JACS:Ramberg–Bäcklund反应合成偕位二氟烯烃
Corma综述:单原子和团簇在反应条件下的动态结构演变
锰催化非活化烯烃的氢化芳基化反应
注意!这5种药物在国外都是禁用的,国内却当成常备药!

JACS:Ni催化非活化烯烃的双官能团化反应

人体细胞内存在“铁路”系统,能自动优化结构

【复材资讯】锂离子电池高能量密度富锂锰基层状氧化物正极材料电压衰减机制研究取得进展
配体促进的铁催化烯烃氢氟化反应

如果医生给你的孩子开这些药,请主动说不!