科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-04
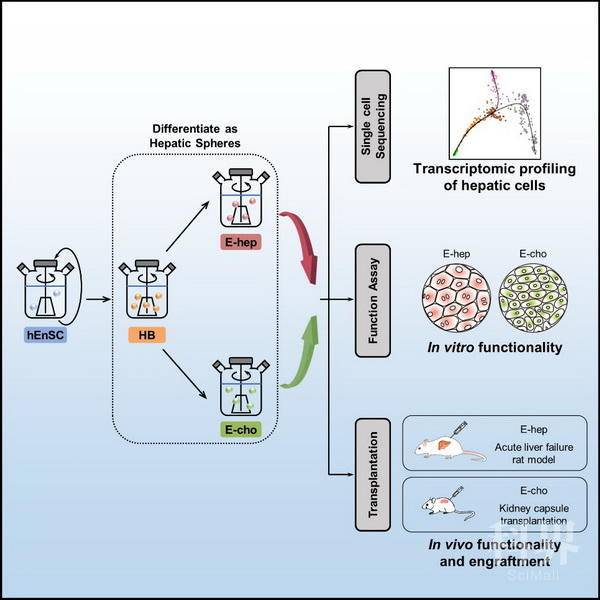
近期,中国科学院分子细胞科学卓越创新中心研究员程新、北京大学生命科学学院教授徐成冉、分子细胞卓越中心研究员陈洛南和上海长征医院教授殷浩合作,在Cell Reports上,发表题为Large-scale Generation of Functional and Transplantable Hepatocytes and Cholangiocytes from Human Endoderm Stem Cells的研究成果。
肝脏由肝实质细胞(hepatocytes)和胆管上皮细胞(cholangiocytes)等多种细胞构成,其损伤及功能紊乱会严重影响人类健康。肝脏移植是目前治疗终末期肝病最有效的手段之一,但其应用受制于供体匮乏。体外再造肝脏组织/器官是解决供体来源的有效途径,但也受制于肝脏细胞的来源限制。此外,肝脏细胞的来源短缺和肝组织体外模型的缺失制约了药物筛选及毒理研究。由于肝脏包含超过1011的肝实质细胞和约1010的胆管上皮细胞,上述应用对肝脏细胞的来源、数量、纯度、质量及安全性等方面提出了要求。因此,建立高效的肝脏细胞体外规模制备及质检体系是应对该挑战的较好选择,其也成为当今转化医学研究的热点和难点。
为了满足肝病治疗及体外药物筛选等应用对肝脏细胞在数量、质量及安全性等方面的要求,研究人员建立了高效的基于人内胚层干细胞系(hEnSCs)的体外规模化肝向分化体系,使规模制备高纯度的肝母细胞、肝实质细胞(E-heps)及胆管上皮细胞(E-chos)成为可能。研究人员利用单细胞转录组测序技术,深入解析了该体系各关键分化步骤的细胞群体,并与原代及其他来源的肝实质细胞进行了系统的对比。功能实验显示,E-heps和E-chos具有成体细胞的分泌、代谢及解毒功能;包囊化的E-heps经移植后可挽救急性肝衰动物;E-chos在小鼠肾包囊下可形成胆管网络。该研究为肝病治疗及疾病模拟提供了细胞规模制备及质检体系。
该研究建立的基于人内胚层干细胞的规模化肝向分化系统为体外药物筛选、肝病模拟、肝脏体外构建以及肝病细胞治疗等应用奠定了技术及理论基础。未来的研究方向将聚焦于体系的优化完善,包括寻找更优的起始种子细胞类型(如双潜能的肝干细胞系等)、进一步降低终末分化细胞的群体异质性、进一步提高终末分化细胞体内整合及再殖能力,进而探索利用体外制备的肝脏细胞构建血管化和胆管化的肝组织以及肝病细胞治疗的可行性。
该研究主要由分子细胞卓越中心程新组博士冯思思、吴佳颖和邓小刚与陈洛南组博士邱伟林以及北京大学徐成冉组博士杨李共同完成,程新、徐成冉、陈洛南和殷浩为论文的共同通讯作者。研究工作得到国家重点研发计划项目、中科院战略性先导科技专项和国家自然科学基金,以及动物平台、细胞分析平台和分子生物学平台等的支持,获得分子细胞卓越中心研究员惠利健和中科院上海药物研究所研究员潘国宇的指导和帮助。
来源:中国科学院
原文链接:http://www.cas.cn/syky/202012/t20201230_4772968.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国科大揭示HBV慢性感染导致肝癌发生的机制
组蛋白甲基转移酶SMYD2在调控人胚胎干细胞向中内胚层分化过程中的新作用和机制

肝脏受伤全过程
科学家鉴定出肝脏中Sox9+双向祖细胞

肝脏受伤全过程
科普丨爱肝日,维护肝脏,增进健康
肝脏好不好,我们对肝脏的了解究竟有多少?

重磅!中共中央、国务院印发《乡村振兴战略规划(2018-2022年)》

中科院等科学家合作研究建立基于人内胚层干细胞的规模化肝向分化系统
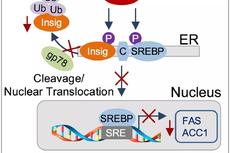
研究发现蛋白质翻译后修饰通过泛素化降解途径调节脂肪酸合成的新机制