科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-04
来源:植物生物学
实验原理:
酵母单杂交(yeast one hybrid)是在酵母双杂交的基础上发展起来的技术,主要用于研究蛋白质和DNA元件之间的相互作用。
真核生物基因的转录起始需转录因子参与.转录因子通常由一个DNA特异性结合功能域和一个或多个其他调控蛋白相互作用的激活功能域组成,即DNA结合结构域(DNA-bindingdomain,BD)和转录激活结构域(activationdomain,AD)。用于酵母单杂交系统的酵母GAL4蛋白是一种典型的转录因子,GAL4的DNA结合结构域靠近羧基端,含有几个锌指结构,可激活酵母半乳糖苷酶的上游激活位点(UAS),而转录激活结构域可与RNA聚合酶或转录因子TFIID相互作用,提高RNA聚合酶的活性。在这一过程中,DNA结合结构域和转录激活结构域可完全独立地发挥作用。据此,我们可将GAL4的DNA结合结构域置换为转录因子编码基因,将顺式作用元件与基本启动子 (minimal promoter , Pmin)和报道基因连接。只要转录因子能与目的DNA元件相互作用,即可通过转录激活结构域激活RNA聚合酶,启动下游报告基因的转录(图1)。
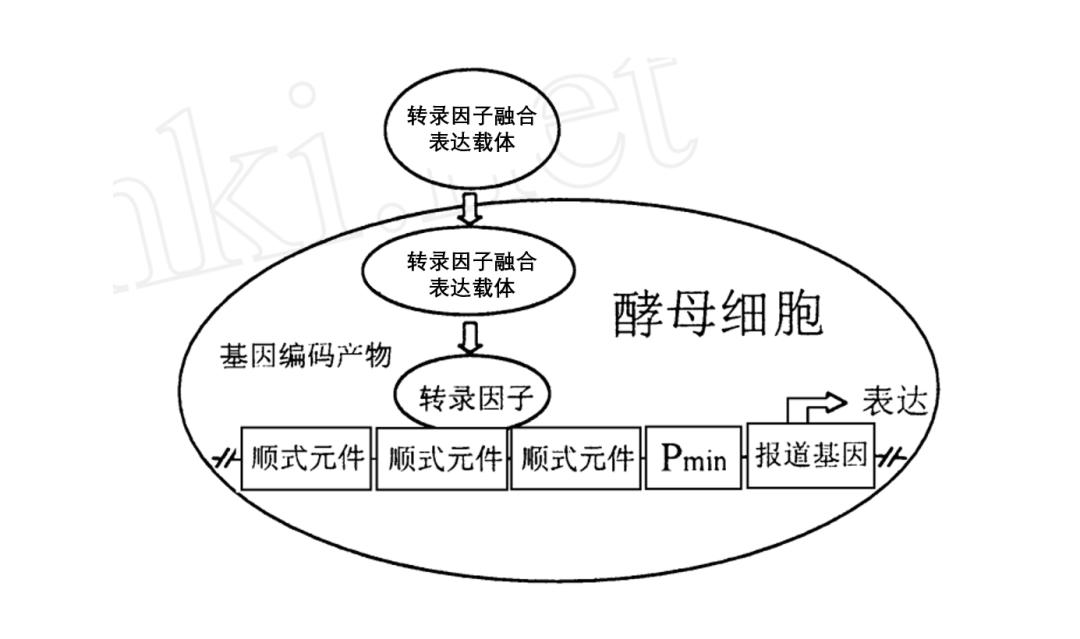
图1. 酵母单杂交文库原理
(改编自陈峰等,生物工程进展,2001)
应用:
酵母单杂交主要有以下3种用途:①确定已知DNA—蛋白质之间是否存在相互作用;②分离结合于目的顺式调控元件或其他短DNA结合位点蛋白的新基因;③定位已经证实的具有相互作用的DNA结合蛋白的DNA结合结构域,以及准确定位与DNA结合的核苷酸序列。
菌株和质粒:
酿酒酵母(Saccharomyces cerevisiae) EGY48菌株(Clontech)、pLacZ2μ和pB42AD酵母表达质粒(图2A, B)。其中, pLacZ2μ连接顺式作用元件(如启动子); pB42AD连接转录因子的编码区序列。
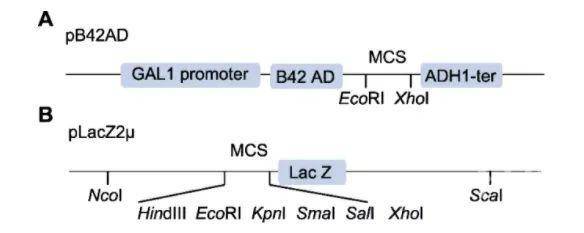
图2 酵母单杂交文库质粒
(引自杨立文等,植物学报,2020)
(A) pB42AD (Clontech);
(B) pLacZ2µ (Lin et al., 2007).
培养基及试剂
YPD酵母全营养培养基、One-step溶液、酵母缺陷型培养基(SD)、棉子糖、半乳糖、10× BU盐以及5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)。相关试剂的配方如下:
YPD酵母全营养培养基: 20 g/L–1 Difco peptone、10 g/L–1酵母抽提物和20 g/L–1葡萄糖。相关试剂均购自OXOID公司。
SD培养基: 6.7 g/L–1 YNBOXOID、20 g/L–1葡萄糖(Cat No.GAO188)、20 g/L–1琼脂以及缺少色氨酸和尿嘧啶的氨基酸混合物(DO/Trp-Ura) (Cat No.630427)。
显色SD培养基: 在SD培养基(不包含葡萄糖)中加入1× BU盐、2%半乳糖、1%棉子糖和80μg/mL–1 X-gal。其中, 10× BU盐: 37.1g/L–1 Na2HPO4和30 g/L–1 NaH2PO4。相关试剂均购自Sigma公司。
One-step溶液(现用现配): 2 mL1 mol/L–1 LiAc (Sigma)、8 mL 50% PEG3350 (Cat No.BCBX- 6102)以及76.9 µL β-巯基乙醇(Cat No. M8210)。
仪器
30°C摇床、30°C恒温培养箱和超净工作台。
实验设计(1) 确定转录因子可能识别的启动子元件, 利用包含该元件的启动子序列进行Y1H分析。
(2) 设置严格的对照实验。对于1组Y1H分析而言, 至少包括3组阴性对照。即pB42AD/pLacZ2µ、pB42AD/ pLacZ2µ重组质粒以及pB42AD重组质粒/pLacZ2µ。可视具体情况添加1组阳性对照, 以排除假阴性结果。
实验前请认真阅读注意事项
(1) 在质粒转化酵母感受态细胞时, 注意加入鲑鱼精DNA以防止外源质粒被酵母细胞降解。
(4) 转化前应先确认质粒的质量和浓度。
(5) 离心获得酵母菌体时, 转速勿超过850 ×g, 以防影响酵母细胞的活性。
(6) 整个操作过程在超净工作台上进行, 防止杂菌污染。
(7) 注意设置严格的阴性对照和阳性对照实验, 以防止假阳性和假阴性结果。
实验流程
(1) 酵母细胞的培养: 将–80°C冻存的EGY48酵母菌株在全营养固体培养基YPD上划线以活化酵母细胞, 30°C倒置培养1–2天。挑取单克隆接种于10 mL YPD液体培养基中, 30°C摇床200 rpm振荡培养12小时。
(2) 酵母感受态的制备: 将酵母菌液分装于1.5 mL离心管中, 每管1 mL。850 ×g离心5分钟, 去上清。加入1 mL无菌dH2O重悬酵母。850 ×g离心5分钟, 去上清。重复2–3次。随后每管加入100 µL One-step溶液, 振荡重悬, 以获得酵母感受态细胞。
(3) 质粒共转化: 在酵母感受态细胞中加入pLacZ2μ和pB42AD融合载体质粒各2.5 µL以及5 µL鲑鱼精DNA, 振荡混匀。45°C孵育30分钟, 每隔10分钟振荡重悬1次。然后均匀涂布于SD/-Trp-Ura固体培养基上, 30°C倒置培养2–4天。
(4) 酵母显色: 挑取菌体划线至添加X-gal的SD/-Trp-Ura显色平板上, 置于30°C黑暗条件下培养1–2天。期间观察显色情况并拍照记录(图3)。
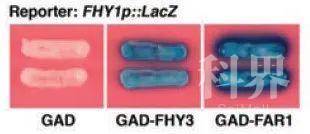
图3. GAD-FHY3激活FHY1下游LacZ报告基因表达
(Lin et al., 2007)。
参考文献
1. 陈峰, 李洁, 张贵友, 刘强. 酵母单杂交的原理与应用实例. 生物工程进展, 2001, 21(4):58-62.
2. 杨立文, 刘双荣, 李玉红, 林荣呈. 植物转录因子与DNA互作研究技术. 植物学报, 2020, 55(4): 468-474 doi:10.11983/CBB20057.
3. Yoo SD, Cho YH, Sheen J (2007). Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nat Protoc 2, 1565-1572.
4. 酵母单杂交技术的原理、基本操作和用途,丁香通。
来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247494552&idx=4&sn=1ff1d670af0e45e305a85517e4334991
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn