科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-16
来源:BioArt
原标题:Cell Research :王金勇/刘兵合作团队利用诱导多能干细胞实现T细胞免疫再生
T 细胞是一类执行获得性免疫功能的免疫细胞,在机体抗肿瘤、抗病毒感染等方面发挥重要作用。近年来,根据T细胞的细胞毒性原理的临床免疫疗法(如CAR-T, TCR-T)成为治疗恶性肿瘤的新手段,部分肿瘤患者经治疗后病情得到缓解甚至治愈,病人生存、生活质量得到显著改善。然而,广大肿瘤患者自身的T细胞常见功能异常或者耗竭,阻碍了这一疗法的广泛应用,因此迫切需要获得广谱、无限来源的新型T细胞。随着制备病人体细胞来源的诱导型多能干细胞(iPSC)技术的日臻成熟,通过诱导iPSC向T细胞免疫谱系分化成为获得无限来源T细胞的关键技术路径。
围绕T细胞体外再生,科学家从模拟T细胞胸腺发育微环境和关键信号通路入手,进行了长期不懈的努力。Juan Carlos Zúñiga-Pflücker博士的研究团队发现,在一种骨髓来源的OP9细胞系中表达NOTCH信号通路配体(DLL1/DLL4),在合适的时间添加FLT3L, IL-7等关键细胞因子,可以体外诱导造血干祖细胞或多能干细胞分化获得部分CD8阳性为主的T细胞,功能试验也证明这些细胞具备一定的免疫功能【1-3】。然而,生理状态下天然T细胞的发育非常复杂,需要在胸腺中与自体多种细胞相互作用经历阳性和阴性选择过程,才能发育成熟为对自体免疫兼容的T细胞库。显然,当前的体外模拟技术尚未成熟,表现为体外产生的T细胞移植到体内产生与宿主免疫不兼容现象,甚至出现严重免疫排斥。
把体外诱导阶段缩短到只产生T细胞种子(T cell precursors),然后移植到体内在胸腺完成T细胞发育的二步法,成为再生功能完备的T细胞的重要研究思路【4, 5】。然而,以多能干细胞(PSC/iPSC)作为起始细胞体外分化获得的T细胞种子,表现出胸腺定植能力缺陷,无法归巢到胸腺就无法发育输出成熟的T细胞【6】。成体造血干细胞能够分化产生包括T细胞在内的各种获得性免疫细胞,因此,诱导多能干细胞或其他细胞类型产生功能上类似天然造血干祖细胞的细胞种子,移植后体内发育为包括T细胞在内的多种谱系细胞的二步法,理论上也可以体内终生输出功能性T细胞【7-10】。然而,迄今这种方法效率极其低下,相关报道的方法,也未见同行领域的后续跟进重复【11, 12】。
早在iPSC诱导技术问世之前,来自Thomas Graf研究团队的中国科学家谢华锋博士在攻读博士后期间就发现成体血液谱系类型之间可以被操纵实现完美命运转换(B细胞转分化为巨噬细胞)【13】。本研究所属的课题组近期也发现Hoxb5能够在体内将天然的B细胞转分化为功能T细胞,为移植后迅速恢复骨髓移植病人早期的免疫力提供了潜在的新思路(Nat Immuno丨王金勇组建立T细胞体内再生新技术—程涛、刘勇军点评)【14】。
除了上述进展,迄今尚没有一种通用、高效的方法来诱导多能干细胞实现体内T免疫系统特异重建。
越来越多的发育学证据表明,在HSC出现之前,就已经出现具有T细胞谱系潜能的造血祖细胞【15-18】。HSC依赖性的T细胞发育关键转录因子报道很多,然而对于在胚胎期非HSC依赖性造血祖细胞发育的内在驱动因素知之甚少。确认非HSC依赖性造血祖细胞的T淋系发育的内在驱动因素(如果存在的话),或许能够帮助我们建立一个可靠的实验方案以实现PSC高效重建T淋系发育。
2019年11月15日,来自中国科学院广州生物医药与健康研究院的王金勇课题组和中国人民解放军总医院第五医学中心的刘兵课题组等国内科研团队在Cell Research上发表了题为Guiding T lymphopoiesis from pluripotent stem cells by defined transcription factors的研究论文,首次报道了转录因子Runx1和Hoxa9协同表达可以高效诱导多能干细胞(PSC)定向分化产生T细胞的种子细胞,将其移植后能够在免疫缺陷鼠体内重建T免疫系统,再生途径恢复了免疫缺陷鼠的T细胞免疫监视功能。采用这种二步法再生T细胞技术方案,该研究进一步基因编辑iPSC,使之带上肿瘤相关抗原特异性TCR(TAA-TCR),成功实现体内再生肿瘤特异性TCR-T细胞,在实体瘤小鼠模型中有效遏制肿瘤生长。这种体内再生的抗肿瘤TCR-T细胞,具备Naïve表型,肿瘤抗原激活后可以产生效应T细胞和记忆T细胞。

在该研究中,作者首先构建了可诱导表达Runx1的ESC细胞系(iRunx1-ESC),并进行了T淋系分化潜能评估,结果移植实验表明体内未产生ESC来源的T细胞。作者对iRunx1-ESC分化获得的单个表型生血内皮细胞 (iHEC) 进行了单细胞测序,并与小鼠胚胎E11 的T1-pre-HSC(CD31+CD41lowCD45-c-Kit+CD201high)单细胞转录组数据进行了比较【19】。结果发现与造血发育相关的几个关键转录因子Hoxa5、Hoxa7、Hoxa9、Hoxa10、Hlf、Ikzf1、Nkx2-3和Setbp1在iRunx1-ESC来源的iHEC细胞中表达量极低。
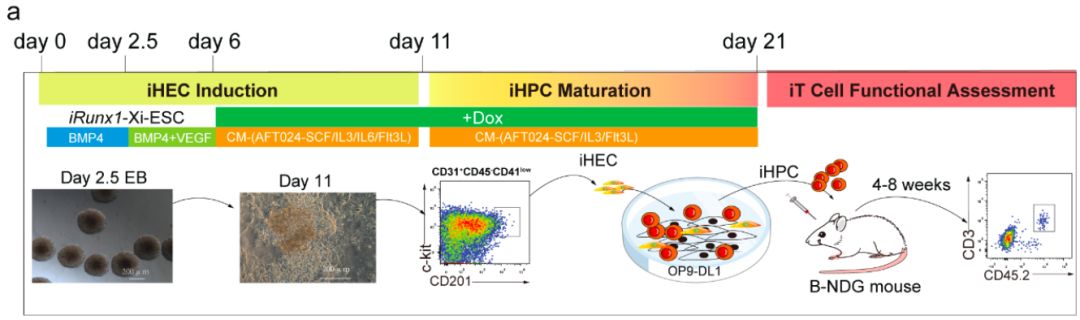
作者进一步采用“iRunx1+Xi”(Xi:Hoxa5、Hoxa7、Hoxa9、Hoxa10、Hlf、Ikzf1、Nkx2-3和Setbp1)串联因子敲入策略继续进行二步法筛选。通过筛选,发现在诱导进程的第6-11天开启外源性Runx1和Hoxa9的表达,可以获得丰富的iHEC细胞类型,而且这些iHEC与胚胎pre-HSC (CD31+CD41lowCD45-c-Kit+CD201high)表型类似。借鉴刘兵教授课题组开发的体外教育HEC向HSC成熟的技术【18】,将iHEC与OP9-DL1(GFP+)基质细胞系共培养10天后,可以检测到大量的iHPC,其中包含有pre-thymic细胞表型(Lin-c-kit+CD127+/CD135+)的祖细胞。为了进一步评估iHPC的体内重建造血谱系潜能,作者将这些iHPC移植到经过亚致死剂量辐照处理的B-NDG小鼠(由中国北京百奥赛图公司研发的一种NSG小鼠品系)中。移植4周后,在受体小鼠外周血成功检测到供体来源的CD45.2+CD3+ T细胞,但未检测到CD45.2+CD19+ B细胞和CD45.2+CD11b+髓系细胞。5组独立实验表明iR9-ESC来源的iHPC能够在超过80%的B-NDG受体小鼠中产生CD3+ iT细胞(iT-B-NDG小鼠,32/40)。
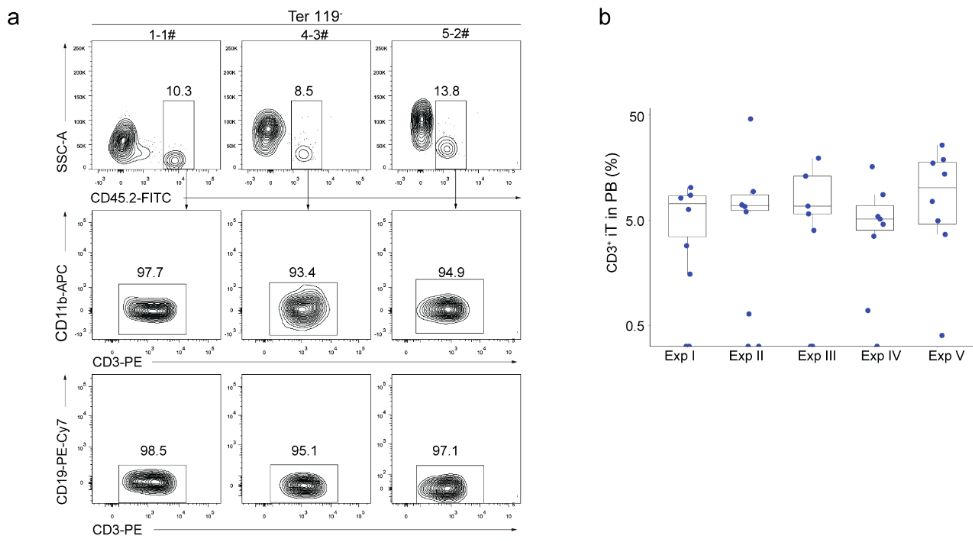
作者进一步分析了iT-B-NDG小鼠中iT细胞的组织分布和免疫表型。在iT-B-NDG小鼠的脾脏、淋巴结和外周血中均检测到成熟TCRβ+CD4SP和TCRβ+CD8SP iT细胞,并在肠道和肺组织中检测到iR9-ES来源的γδ iT细胞。在iT-B-NDG小鼠的脾脏和骨髓中也检测到诱导型NK细胞(iNK,CD45.2+NK1.1+CD3-)。作者进一步发现在iT-B-NDG小鼠的胸腺中存在着诱导产生的CD4SP细胞、CD8SP细胞、DP细胞和DN淋巴细胞。其中,在移植4周后iDN细胞主要停留在iDN1阶段,在移植5周后iDN细胞主要停留在iDN2和iDN3阶段。作者进一步在骨髓里检测到iR9-ES来源的Lin-Sca1+c-Kit+ (iLSK)祖细胞。为了评估再生的iLSK细胞是否能够重构小鼠的T淋巴谱系,作者从iT-B-NDG小鼠(移植后6周)中分选iLSK细胞,并进行二次移植实验。二次移植6周后,可以在受体小鼠的外周血、骨髓和脾脏中检测到成熟的iT细胞。作者进一步通过TCR深度测序确认了iT细胞具有丰富的TCRαβ多样性。上述结果表明iR9-ESC来源iHPC在体内采用与天然T细胞发育相似的模式重建再生型T淋系发育。
为了进一步验证iR9-ESC分化再生T细胞的效率,作者分选了iR9-ESC来源的单个iHEC细胞,分别在体外和体内进行了iT细胞诱导分化实验。结果表明,单个iHEC细胞不但能够在体外高效再生iT细胞,产生的单个造血集落还可以在体内重建T淋系发育。作者接着通过单细胞RNAseq对iHEC以及与OP9-DL1共培养不同天数产生的iHPC进行组学解析,发现iHEC表现出与胚胎EC和pre-HSC相似的分子特征。更重要的是,iHEC来源的iHPC表现出与胸腺定植相关的基因表达特征,例如表达Kit、Flt3、Cd7和Ccr9。
此外,为了评估iR9-ESC再生的iT细胞的功能,作者进行了异体皮肤免疫排斥实验,发现iT细胞展现出典型的免疫监视功能,介导异体皮肤免疫排斥反应并保留免疫记忆。基于iPSC存在着细胞来源不受限制和易于进行基因编辑的优势,作者将肿瘤抗原特异性TCR(MHC-I限制性OVA TCR,OT1)引入到iR9-iPSC中,评估iPSC来源的OT1-iT细胞的抗肿瘤活性。令人振奋的是,TCR修饰的iPSC产生的iT细胞能够在实体瘤模型中展现出抗肿瘤活性。这些结果证明再生的iT细胞具有生理和抗肿瘤免疫功能。
总之,该研究建立了一种通过特定转录因子(Runx1和Hoxa9)组合诱导多能干细胞定向分化为T细胞种子的方法。在单细胞水平确认了T谱系命运早在生血内皮细胞阶段就已经决定,早于HSC的出现。分化再生的iHPC具有真正pre-thymic造血祖细胞的特征,具备胸腺定植功能。该研究利用多能干细胞为材料,重建T免疫系统,而且实现重建具有治疗意义的T细胞抗肿瘤免疫,为T细胞相关免疫缺陷(如艾滋病)和T细胞抗肿瘤等转化研究,提供了新的技术借鉴。据悉该技术业已申请国际PCT优先权,并获得中国专利授权保护。
原文链接:
https://www.nature.com/articles/s41422-019-0251-7
参考文献
1. Schmitt, T. M. & Zuniga-Pflucker, J. C. Induction of T cell development from hematopoietic progenitor cells by delta-like-1 in vitro. Immunity 17, 749-756 (2002).
2. Mohtashami, M. et al. Direct comparison of Dll1- and Dll4-mediated Notch activation levels shows differential lymphomyeloid lineage commitment outcomes. J Immunol 185, 867-876, doi:10.4049/jimmunol.1000782 (2010).
3. Montel-Hagen, A. et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell stem cell 24, 376-389 e378, doi:10.1016/j.stem.2018.12.011 (2019).
4. Awong, G. et al. Human proT-cells generated in vitro facilitate hematopoietic stem cell-derived T-lymphopoiesis in vivo and restore thymic architecture. Blood 122, 4210-4219, doi:10.1182/blood-2012-12-472803 (2013).
5. Shukla, S. et al. Progenitor T-cell differentiation from hematopoietic stem cells using Delta-like-4 and VCAM-1. Nature methods 14, 531-538, doi:10.1038/nmeth.4258 (2017).
6. Schmitt, T. M. et al. Induction of T cell development and establishment of T cell competence from embryonic stem cells differentiated in vitro. Nature immunology 5, 410-417, doi:10.1038/ni1055 (2004).
7. Sandler, V. M. et al. Reprogramming human endothelial cells to haematopoietic cells requires vascular induction. Nature 511, 312-318, doi:10.1038/nature13547 (2014).
8. Sugimura, R. et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature 545, 432-438, doi:10.1038/nature22370 (2017).
9. Riddell, J. et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell 157, 549-564, doi:10.1016/j.cell.2014.04.006 (2014).
10. Lis, R. et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature 545, 439-445, doi:10.1038/nature22326 (2017).
11. Stik, G. & Graf, T. Hoxb5, a Trojan horse to generate T cells. Nat Immunol 19, 210-212, doi:10.1038/s41590-018-0053-y (2018).
12. Dzierzak, E. & Bigas, A. Blood Development: Hematopoietic Stem Cell Dependence and Independence. Cell Stem Cell 22, 639-651, doi:10.1016/j.stem.2018.04.015 (2018).
13. Xie, H. et al. Stepwise Reprogramming of B Cells into Macrophages.Cell 117,663-676, https://doi.org/10.1016/S0092-8674(04)00419-2 (2002).
14. Zhang, M. et al. Transcription factor Hoxb5 reprograms B cells into functional T lymphocytes. Nature immunology 19, 279-290, doi:10.1038/s41590-018-0046-x (2018).
15. Yoshimoto, M. et al. Autonomous murine T-cell progenitor production in the extra-embryonic yolk sac before HSC emergence. Blood 119, 5706-5714, doi:10.1182/blood-2011-12-397489 (2012).
16. Luis, T. C. et al. Initial seeding of the embryonic thymus by immune-restricted lympho-myeloid progenitors. Nature immunology 17, 1424-1435, doi:10.1038/ni.3576 (2016).
17. Tian, Y. et al. The first wave of T lymphopoiesis in zebrafish arises from aorta endothelium independent of hematopoietic stem cells. The Journal of experimental medicine 214, 3347-3360, doi:10.1084/jem.20170488 (2017).
18. Zeng, Y. et al. Single-Cell RNA Sequencing Resolves Spatiotemporal Development of Pre-thymic Lymphoid Progenitors and Thymus Organogenesis in Human Embryos. Immunity, doi:10.1016/j.immuni.2019.09.008.
19. Zhou, F. et al. Tracing haematopoietic stem cell formation at single-cell resolution. Nature 533, 487-492, doi:10.1038/nature17997 (2016).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477848&idx=1&sn=ae800e32627313d9a59e2f9d136763e4&chksm=84e20a2cb395833abe2abf6362cd54d3df73dafee2554a3862ba1388cbf75524b6b93e82fde5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
干细胞 cell 肿瘤免疫 doi 诱导多能干细胞 细胞免疫 细胞分化

3D迷你大脑,助力脑功能修复研究
广州生物院在动物模型上实现诱导多能干细胞来源CAR-T细胞抗肿瘤

广州生物院在动物模型上实现诱导多能干细胞来源CAR-T细胞抗肿瘤
中国首个干细胞通用标准发布,规范国内行业发展

广州健康院等通过特定因子诱导多能干细胞实现再生T细胞技术突破
中国科协发布2016年度“中国生命科学领域十大进展”
CELL:适应性免疫抗性从肿瘤起始干细胞中出现

日本批准用诱导多能干细胞治疗帕金森病
皮肤变肌肉不再是幻想,科学家们做到了!

中科院等科学家合作通过特定因子诱导多能干细胞研究实现再生T细胞技术突破