科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-16
来源:宏基因组
摘要:在陆地土壤和水生环境中,矿物—微生物的相互作用广泛地受到研究者的关注。然而,陆地热泉作为极端生态环境之一,其中的微生物群落与沉积物中矿物的相互作用与相关性的研究较少。热泉沉积物中的矿物颗粒可以为微生物提供附着生态位,或作为电子供体或受体利于微生物的定殖与生存,而微生物群落的差异可能导致矿物组分产生差异。本研究以云南腾冲热泉作为研究对象,进行原位矿物的微生物培养实验,结合生物分子学手段探究不同类型的矿物对热泉微生物群落结构及多样性的影响。相比于其他陆地生态环境,由于热泉极端的温度和pH等环境条件,导致直接使用DNA提取试剂盒得到的DNA其质量较差且浓度偏低,因而本方法在使用传统DNA提取试剂盒的基础上对其改进,采用对微生物循环冻融、加入苯酚:氯仿:异戊醇 (25:24:1) 等方式优化DNA的提取步骤,提高DNA的质量与产量,对极端生态系统低生物量生态环境的DNA提取具有一定的借鉴意义。
关键词:热泉,微生物,培养矿物,低质量DNA
材料与试剂
1.DNA提取试剂盒:品牌QIAGEN, PowerSoil® DNA Isolation Kit强力土壤DNA提取试剂盒,catalog number: 12988-10;试剂盒提供的溶液与材料包括:BowerBead Solution,C1,C2,C3,C4,C5,50 ml无菌离心管,DeNase Purmax过滤柱,2 ml无菌离心管
2.1 M Tris-HCl缓冲液 (pH 8.0):品牌Solarbio,catalog number: T1150,常温保存
3.DNA提取液:苯酚:氯仿:异戊醇 (25:24:1) (pH > 7.8),catalog number: P1012,4 °C避光保存
4.无水乙醇:北京东方博远科技发展有限公司
5.50 ml无菌离心管:Corning,catalog number: 430828
6.200 µl、1 ml、5 ml枪尖与移液枪 (枪头适量扩大口径以减小剪切力对核酸的损伤,可用剪刀稍剪一下)
7.2 ml离心管:需提前高温蒸汽灭菌 (121 °C,30 min)
8.去离子水
9.三水合乙酸钠:西陇化工股份有限公司,catalog number: 6131-90-4 (见溶液配方)
10.70%乙醇 (见溶液配方)
仪器设备
1.离心机:
1)品牌eppendorf, model: Centrifuge 5810R冷冻高速离心机
2)品牌eppendorf,model: Centrifuge 5417R冷冻高速离心机
2.涡旋仪:品牌Scientific Industries,model: Vortex Genie-2;水平50 ml离心管支架,catalog number: SI-H506
3.浓缩仪:品牌eppendorf,model: Concentrator plus真空离心浓缩仪
4.水浴锅:上海一恒科技有限公司,HWS12型电热恒温水浴锅
5.电子天平:梅特勒-托利多仪器上海公司,品牌HANGPING,model: JA2003N
6.超净工作台:品牌苏净安泰,model: YJ-1340型
7.通风橱:北京鸣远实验家具公司,model: MYLAB
8.纯水仪:美国Milli-Q型号纯水仪
实验步骤
1.使用电子天平称取10 g热泉原位培养矿物,加入10 ml PowerBead Solution和1 ml溶液C1;
注:原位培养前,已将矿物研磨至粒径大小≤2cm×2cm×2cm,以保证DNA提取的便捷;如若矿物粒径太大,可考虑使用液氮研磨
2.于通风橱内加入5 ml的DNA提取液;
3.将得到的样品溶液放置于涡旋仪上,使用最大转速涡旋30 min;
4.进行3次循环冻融:将样品置于液氮内3 min,取出后立即65 °C水浴加热5 min;或者将样品放置于-80 °C冰箱内冷冻10 min,取出后立即65 °C水浴加热5 min;
5.将样品溶液在转速5000 x g下离心8 min,将上清液转移至新的50 ml离心管内。
注:对于较低转速的离心机可适当增加离心时间,例如2500 x g,15 min。
6.加入1.5 ml溶液C2,涡旋5 s使其混合均匀。再加入1 ml溶液C3,涡旋5 s使其混合均匀。放置于4 °C冰箱内孵育10 min;
注:C2、C3提前保存在4 °C冰箱中。
7.取出样品,在转速5000 x g下离心5 min,将上清液小心地转移到新的50 ml离心管内;
注:转移体积大约13-14 ml,视实际情况而定。
8.依次加入与步骤7等体积的溶液C4和无水乙醇,使用涡旋仪使溶液充分混合;
9.从上述混合溶液内取出15 ml,加载到过滤柱上;转速5000 x g下离心3 min,丢弃下部滤液;
10.重复步骤11,直到混合液全部被加载到过滤柱上;
11.向过滤柱加入改良的C4溶液15 ml后,直接5000 x g,离心3 min,丢弃滤液;
注:具体改良方法见溶液配方。
12.向过滤柱中加入10 ml溶液C5后,直接5000 x g,离心3 min,丢弃下部滤液。重复一次该步骤;
13.向过滤柱中加入10 ml无水乙醇后,直接5000 x g,离心3 min,丢弃下部滤液。重复一次该步骤;
14.将过滤柱在 5000 x g空离心10 min以除去多余的无水乙醇;
15.将过滤柱放置于新的50 ml无菌离心管中,转移至超净工作台内,开盖使其在空气中干燥10 min;
16.向过滤柱中加入2 ml Tris-HCl反应静置3 min,5000 x g离心5 min;
注:Tris-HCl需提前放入65 °C烘箱内预热。
17.收集下部离心管内的DNA溶液,小心地将其转移至新的2 ml无菌离心管中;
注:可以一个样品分装2管,每管1 ml。
18.将得到的DNA溶液放入浓缩仪内,将液体体积浓缩至0.5 ml左右;浓缩仪设置:温度25 °C,V-AQ模式,45-55 min左右;
19.向浓缩后的DNA溶液中加入0.1倍体积 (约50 µl) 的乙酸钠(3 mol/L,PH = 5.2),并简单涡旋混合均匀,此时获得约0.55mL的DNA混合液;
20.再加入2倍DNA混合液体积的 (约1.1 ml) 冰冻无水乙醇 (需提前放入4 °C冰箱内),简单涡旋混合均匀,放置于-20 °C的冰箱中大于1 h;
21.从冰箱取出第20步中的混合液在16,000 x g下离心10 min,小心地移除上清液;
22.加入1 ml的冰冻70%乙醇 (需提前放入4 °C冰箱内),简单涡旋后,16, 000 x g下离心2 min,小心地移除上清液,重复一次该步骤;
23.于室温下将离心管开盖置于超净台中,以使残留的乙醇完全挥发;或者将离心管置于浓缩仪中,45 °C,V-AL模式,浓缩10 min左右;
24.向离心管内加入50 µl的Tris-HCl溶液, 简单涡旋振荡DNA保存在溶液中;并将其放置在-80℃冰箱,以备后续PCR扩增
注:Tris-HCl溶液需提前放65 °C烘箱中预热。
注意事项
1.对微生物进行反复冻融的过程中推荐使用液氮冷冻与水浴的方法,冷冻时间短,且冷冻彻底。如置于-80 °C冰箱内可以适当增加冷冻时间,避免因为冷冻不彻底而导致微生物细胞的裂解不充分。
2.所有操作步骤均推荐在超净工作台内进行,且所用枪尖均需要进行高温蒸汽灭菌 (121 °C,30 min),避免对样本微生物造成污染。
3.实验最后一步加入Tris-HCl溶液的体积为50-100 µl,实验中可根据生物量适当减少加入的Tris-HCl体积,例如减少至25 µl。如DNA含量过低,可使用浓缩仪对溶液进行适当的浓缩。
4.实验中的无水乙醇与70%乙醇需提前放入4 °C冰箱内冷却;Tris-HCl溶液需提前放入65 °C烘箱内加热。
5.干燥DNA的时间不宜过长,且浓缩仪对DNA溶液进行浓缩时应控制浓缩时间(浓缩仪对水的浓缩速度通常为0.1 ml/15 min),避免溶液的完全挥发,对DNA造成损伤。
6.试剂盒中的C5用量较大,可能需要单独购买 (catalog number: 160023921)。
溶液配方
1.乙酸钠 (终浓度3 M,pH 5.2)
称取40.8 g的三水合乙酸钠颗粒,加入100 ml的去离子水,搅拌使其完全溶解,加入约200 µl的1 N HCl调整pH至5.2,高温蒸汽 (121 °C,30 min)进行灭菌,置于阴凉处室温保存
2. 70%乙醇
将无水乙醇与去离子水以7:3 (v/v)混合,置于4 °C冰箱内冷冻保存。
3. 改良的C4溶液
向50ml无菌离心管中加入9:11 (v/v)的溶液C4:无水乙醇
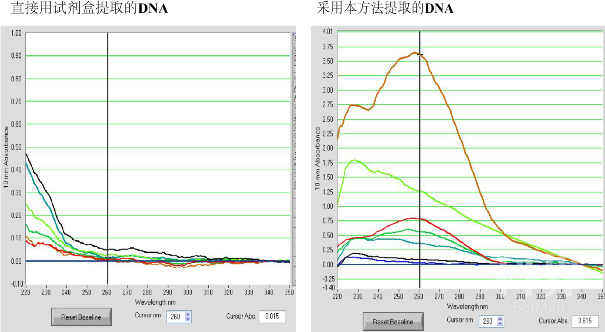
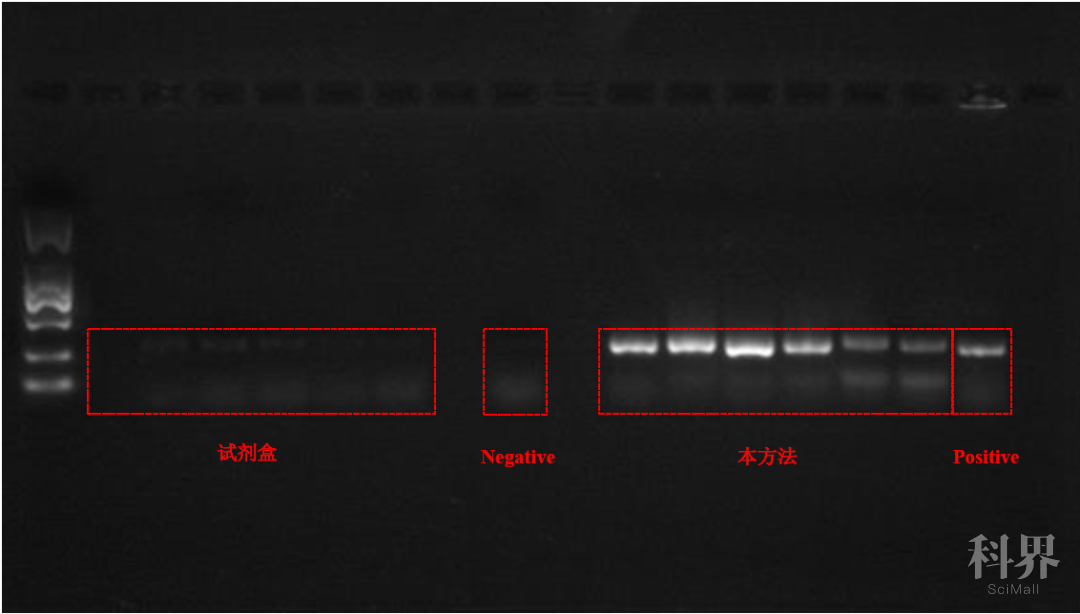
琼脂糖凝胶电泳照片对比:
来源:meta-genome 宏基因组
原文链接:http://mp.weixin.qq.com/s?__biz=MzUzMjA4Njc1MA==&mid=2247495098&idx=2&sn=9f74ddde1a7624d687aa770f7ed2d43e
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

我科学家摸清中国陆地生态系统固碳“家底”

“火山灰中,远古陆地”发掘者—王军

迄今最古老蝎子或是从海洋走向陆地

土壤与地下水环境分会场顶级专家齐聚一堂
舰载火炮比陆地的火炮厉害吗?

土壤污染防治法草案一审二审三审回顾

全国学会新鲜事丨带你去看全国学会最近一周举办了哪些活动!

揭示陆地棉早熟遗传机制

为招蜂引蝶给陆地棉花瓣“上妆”
陆地生态变化卫星遥感