科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-19
来源:中山大学
11月4日,我院徐安龙教授课题组在细胞学权威期刊Nature Cell Biology上发表了题为Mitochondria-localised ZNFX1 functions as a dsRNA sensor to initiate antiviral responses through MAVS的研究论文。王遥博士后、元少春教授和贾鑫副研究员为该论文的共同第一作者,徐安龙教授为该论文的通讯作者。研究首次鉴定到定位于线粒体的dsRNA受体ZNFX1,发现其通过与线粒体上的接头分子MAVS相互作用,在病毒感染的早期诱导I型干扰素(type I IFN)等ISGs的产生,从而正调控RIG-I介导的抗病毒免疫应答。该研究不仅为抗病毒免疫复杂性的理解提供了新的见解,也为病毒感染性疾病的诊断和治疗提供全新的分子靶点。另外,由于ZNFX1属于RNA解旋酶SF1家族的分子,该研究有望开启对SF1家族分子天然免疫功能的全面探索。

模式识别理论是固有免疫的基石。宿主的固有免疫系统通过模式识别受体PRRs识别各种入侵微生物的病原相关分子模式PAMPs,是免疫应答启动的关键。过去二十年,多种特异性识别病毒核酸的PRRs被相继发现,如特异识别病毒dsRNA成分的RIG-I、MDA5,以及识别dsDNA成分的cGAS、IFI16等。发现和鉴定新的核酸识别受体,并探究这些受体与已知受体在识别机制、细胞定位及免疫效应等方面的差异,是近年来免疫学研究的热点之一。
为发现新的抗病毒免疫调节机制,徐安龙课题组早在2017年就利用自主开发的IVT-SAPAS技术对病毒感染的人鼠原代巨噬细胞进行了全基因组可选择性多聚腺苷酸化(APA)位点的扫描。发现全基因组水平,平均3’UTR的长度随病毒感染逐渐缩短,揭示了APA在天然免疫调控方面的重要功能。相关成果2017年发表于Nature Communications上。
在此基础上,课题组进一步对IVT-SAPAS的测序数据进行深度挖掘,并利用siRNA筛选了数十个在病毒感染后发生表达量显著变化的基因,发现RNA解旋酶SF1家族成员ZNFX1具有显著抑制RNA病毒复制的功能。进一步功能分析表明,ZNFX1是一个干扰素诱导基因(interferon stimulated gene, ISG),定位于线粒体外膜上。病毒感染后,ZNFX1通过ARM和P-loop结构域结合病毒的dsRNA,并与定于线粒体的接头分子MAVS相互作用,激活I型干扰素信号通路,发挥抑制RNA病毒复制的功能。由于在静息状态下,ZNFX1具有较高本底蛋白表达,提示ZNFX1在RNA病毒感染早期阶段,即可通过诱导IFNs和ISGs表达形成对RLRs信号通路的正反馈调节。
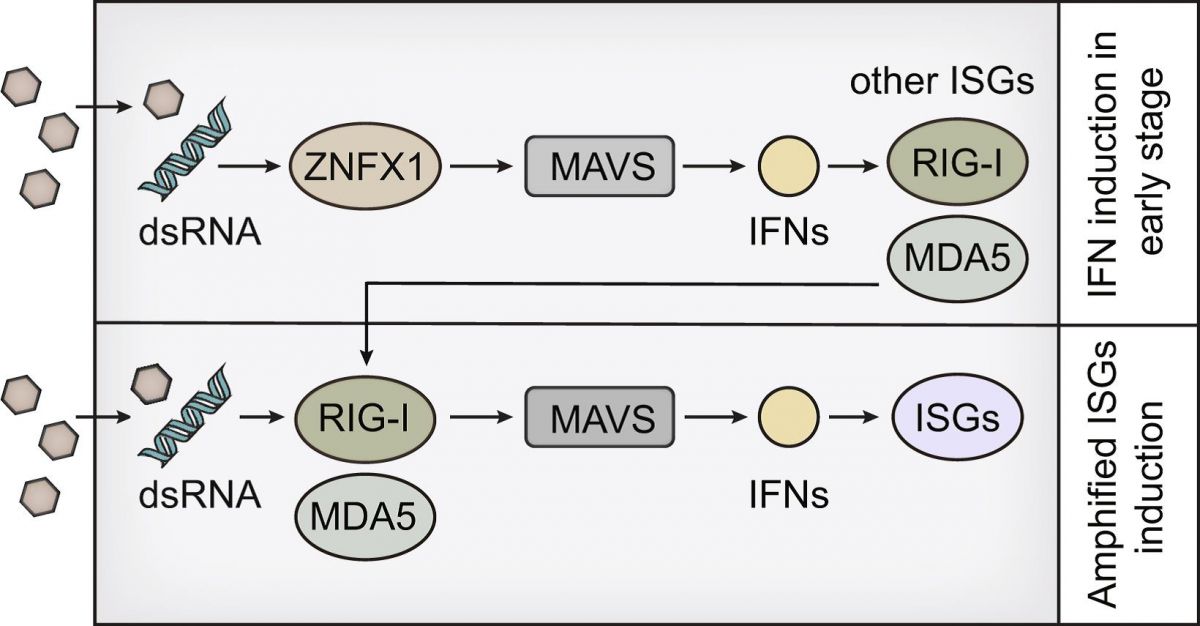
Mitochondria-localized ZNFX1 functions as a dsRNA sensor to initiate antiviral responses through MAVS.
值得一提的是,徐安龙课题组本年度还通过文昌鱼免疫学研究,发现了另一个进化上高度保守的dsRNA识别受体DDX23。通过回溯到哺乳动物中开展比较免疫学研究,发现DDX23主要定位于细胞核内。在病毒感染早期,DDX23可从细胞核转位到细胞质,通过识别病毒来源的dsRNA并激活type I IFN等ISGs的表达,正反馈调节RIG-I介导的抗病毒信号通路。该论文于2019年 9月18日发表在Frontiers in Immunology上,元少春教授及徐安龙教授为该论文的共同通讯作者。
Nat Cell Biol文章的全文链接:https://www.nature.com/articles/s41556-019-0416-0
Front Immunol文章的全文链接:https://www.frontiersin.org/articles/10.3389/fimmu.2019.02202/full
可预防冠状病毒感染的候选分子被发现
《自然》发文:麻省理工学院发现海洋中一种未知病毒

三文鱼感染新冠概率较低?专家:病毒感染宿主需有细胞受体

黄昆团队发现新冠病毒感染肾脏新受体
科研团队发现可预防冠状病毒感染作用的候选分子

评论:“坏兔子”病毒闹心,怎样才能将网络恶棍拦在门外
神秘的巨型病毒!Cell发文揭示病毒感染过程

你身体里也有病毒基因:存在于众多生命中
病毒感染免疫检测

武汉病毒所揭示裂谷热病毒感染机制