科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-19
来源:X一MOL资讯
大自然无疑是最伟大的化学家,数量庞大、结构多变、活性丰富的天然产物就是她的杰作。这样说来,天然产物的全合成,就像人类化学家在合成领域与她进行的深邃对话。当前的天然产物全合成按照其实现方式可分为两大“门派”,一派走有机反应合成路线:基于缜密设计,通过若干步反应高效、精确合成目标产物,堪称“化学艺术”。从R. B. Woodward到E. J. Corey、K. C. Nicolaou,还有现在如日中天的P. S. Baran等等,都是这一门派代表人物。另一派则是在生物遗传学指导下,利用“生物合成基因—合成酶—天然产物”机制合成目标产物。尤其是在聚酮合酶(PKS)和非核糖体肽合成酶(NRPS)领域,成果丰硕,充满“生物智慧”。那么,这两大门派的研究有没有交叉呢?当“生物智慧”邂逅“化学艺术”,又会迸发出怎样的火花?美国洛克菲勒大学的Sean F. Brady教授团队,近期就做了这样一例“从生物中来到化学中去”的交叉研究。

Sean F. Brady教授。图片来源:Rockefeller University
近年来,大量资源投入到人类微生物基因组的测序和生物信息学分析中,揭示出越来越多的天然产物生物合成基因簇(biosynthetic gene clusters, BGCs),其中不少BGCs在自然条件下并没有表达,也就不参与生物合成,称为“沉默BGCs”。对于学术界来说,“沉默BGCs”相当于一个有待开发、潜力巨大的信息库。那么如何去开发它呢?Sean F. Brady教授没有走“基因表达—酶—合成天然产物”的大众路线,而是采用“合成-生物信息天然产物(synthetic- Bioinformatic Natural Products, syn-BNPs)”方法,用生物信息学算法代替基因转录、翻译和体内酶催化的天然产物生物合成,从而预测这些沉默BGCs的产物,随后再进行体外化学合成。
他们以人类微生物基因组中的非核糖体肽合成酶(NRPS)的BGCs为研究对象,希望在“syn-BNPs”方法指导下,利用固相多肽合成技术,合成出生物活性好、结构多样的天然产物环肽。他们分析了1298条人类相关细菌的NRPS-BGCs,从中筛选鉴定出48条有价值的沉默NRPS-BGCs,其中25条适合syn-BNPs的结构预测。这48条BGCs超过一半来自口腔细菌,其余分别来自胃肠道、皮肤、泌尿生殖道、呼吸道和血液。从分类上看,这些BGCs主要来自变形菌门,其次是放线菌门和厚壁菌门(图1)。

图1. 生物信息学分析人类基因组鉴定出48条NRPS BGCs。图片来源:J. Am. Chem. Soc.
有趣的是,这与从其它环境中分离培养的细菌种群结构有很大的区别。一般情况下,放线菌门被认为贡献的活性天然产物最多,本实验贡献BGCs最多的中却是变形菌门。拟杆菌门被认为在人类微生物种群中最常见。但是在实验中,该类细菌未贡献目标BGCs。意外也许是新发现的起点,Sean F. Brady坚信筛选出的NRPS-BGCs是指导下一步环多肽合成的“理想说明书”。
虽然获得的“说明书”对于多肽序列的预测非常好,但是却难以预测环化的模式。在经典的NRPS生物合成中,多肽环化因内部亲核试剂的不同,可分为三种模式,分别是:(1)多肽链N末端作为亲核试剂(cHT式);(2)氨基酸侧链作为亲核试剂(cSC式);(3)在N-酰化多肽中一端的脂肪酸上N可作为亲核试剂(cFA式)(图2a)。
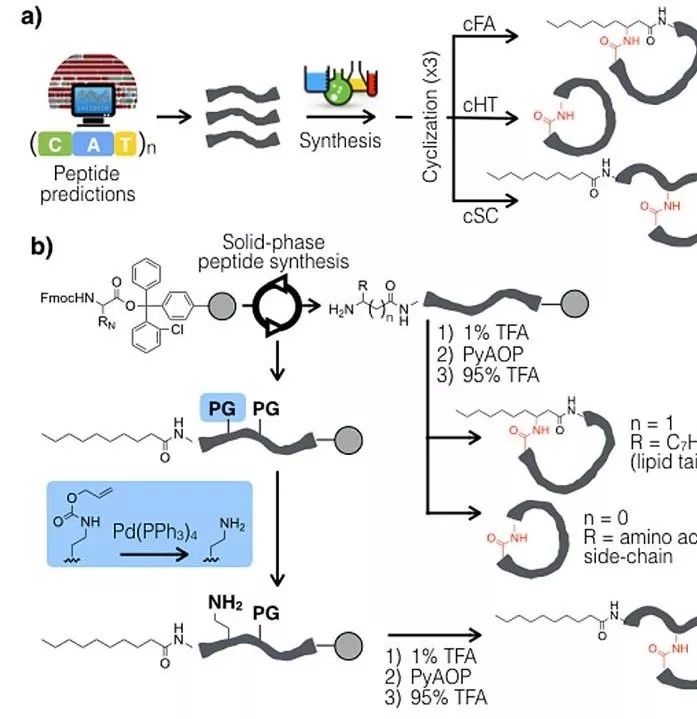
图2. (a) 25条BGCs生物信息学预测多肽与化学合成;(b) 合成3种一般环肽构型的方案。图片来源:J. Am. Chem. Soc.
既然不确定是哪一种环化模式,那就3种都合成吧。他们选择固相多肽合成技术,针对每一个NRPS-BGCs合成了上述3种模式环肽。他们对已知环状非核糖体肽(NRP)分析显示,如果存在2个以上的亲核侧链,主体结构成环倾向于形成最大环,而含脂肪酸的环肽经常通过脂肪酸的-氧化成环。基于这些分析,他们用2,3-二氨基丙酸代替丝氨酸/苏氨酸进行侧链环化,用3-氨基癸酸合成所有含脂肪酸的环肽(图2b)。
他们从25条NRPS-BGCs中预测出30条多肽序列,共合成86个syn-BNP目标环肽,其中4个多肽因为没有任何亲核氨基酸,无法合成侧链环肽而排除。经过一系列化学处理以及高压液相色谱纯化,最后得到72个目标环肽用于生物分析。
他们将获得的环肽进行生物活性测试。首先筛选其抑制金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、白色念珠菌(Candida albicans)的能力。遗憾的是,没有筛选到任何环肽有抑制上述细菌、真菌的能力。随后,他们用MTT代谢活性分析法,测试了环肽对人宫颈癌细胞系(HeLa细胞系)的抑制能力(图3),得到了5个活性环肽(syn-hoagimin A、syn-hoagimin B、syn-rhodomin、syn-parascrofin、syn-kroppenstin,图4)。
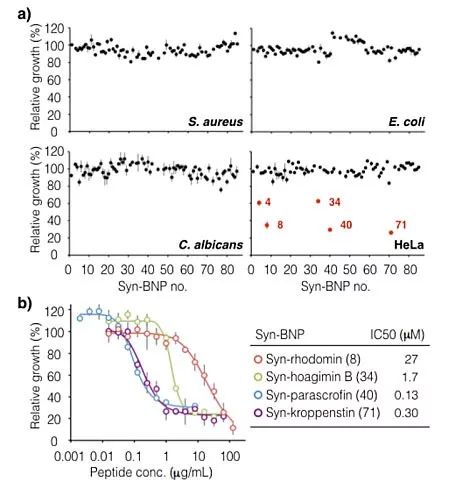
图3. (a) 单剂量syn-BNP环肽抑制细菌、真菌、HeLa细胞生长的作用;(b) 活性syn-BNP环肽对HeLa细胞生长抑制作用的量效曲线。图片来源:J. Am. Chem. Soc.
为了验证观察到的活性,Brady团队将活性好的5个环肽重合成、纯化,并用高分辨质谱鉴定,然后用MTT法重新测试。在4种细胞系(HeLa、HT-29、A549、NCl-H1299)测试中,5个环肽显示了从微摩到纳摩的抑制活性。在这些活性环肽当中,syn-rhodomin和syn-hoagimin的BGCs来自Rhodococcus hoagii,分离自人类皮肤,是一种条件致病菌。Syn-parascrofin的BGCs来自细菌Mycobacterium parascrofulaceum,分离自人类呼吸系统,也是条件致病菌。Syn-kroppenstin的BGCs来自细菌Kroppenstedtia eburnea,是一种好氧、产芽孢的革兰氏阳性菌,可来自人类和其他自然环境,此菌致病性还有待确认(图4)。
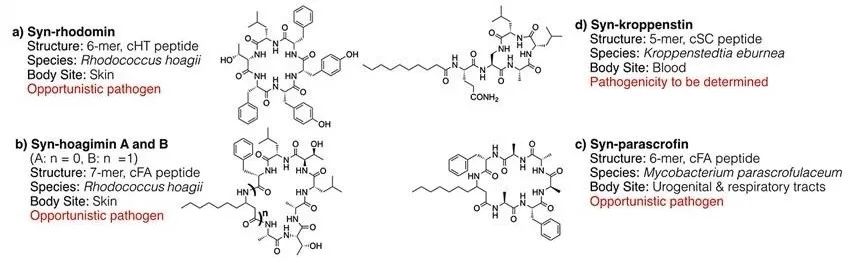
图4. 具有生物活性的syn-BNP环肽结构和其细菌基因组来源。图片来源:J. Am. Chem. Soc.
以往研究通过生物信息学挖掘“沉默生物合成基因簇”,往往是创造合适的生物化学环境让其表达,例如将基因簇异源表达,然后再检测其合成的天然产物。Sean F. Brady团队用生物信息学+有机化学合成的方式,直接”破解“出沉默天然产物生物合成基因簇里的信息,合成出结构新颖复杂,生物活性好的环肽。这样的操作堪称“生物智慧”与“化学艺术”结合的完美范例。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657623436&idx=2&sn=1d6bd07aac9bc1a746c9fc240d28ed3b&chksm=80f8345cb78fbd4ab00e2d732f7b4588b9685d6bb5ba1fbfd085c60e25a55ef7f879f9514a63&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

CCF龙星计划—生物信息学课程圆满结束

交大团队开发微生物信息学新软件推进病原细菌可移动基因组研究

分支动态丨生物信息学与智能信息处理2020年学术会议 (BIIP 2020) 在线会议圆满召开
“2016海峡两岸植物生物学青年科学家学术论坛” 在中国计量大学顺利举行

学会动态丨CAAI生物信息学与智能信息处理2019年学术会议在南京举行

专访 | 张泽民:单细胞测序+生物信息学,“左膀右臂”助力肿瘤免疫研究
CAAI生物信息学与人工生命专委会进高校系列活动:人工智能进厦大




梁承志:大数据爆发让生物信息学“C位出道”

“暗箱”待开 生物信息学下一个十年在哪里?
2016全国植物生物学大会在武汉成功举办