科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-02-08
内容来源:中国科学院
1月26日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员丛尧团队与朱学良团队的最新合作研究成果以Distinct architecture and composition of mouse axonemal radial spoke head revealed by cryo-EM为题,在线发表在PNAS上。该研究综合应用冷冻电镜、细胞生物学及生物化学方法,首次解析了鼠源辐射轴头部复合体的3.2埃分辨率冷冻电镜结构,揭示了高等动物辐射轴复合体在进化过程中的差异,以及辐射轴在纤毛摆动过程中发挥作用的结构机制。
辐射轴(radial spoke,RS)是从轴丝二联微管伸出的由二十多个亚基形成的超大分子复合体。在运动纤毛或鞭毛中,RS头部接触中央微管(central pair,CP)附属结构,将机械信号和化学信号从中央微管传输到轴突动力蛋白臂,从而发挥协调纤毛运动的功能。尽管RS组分在进化中得以保留,但RS头部复合体在原生动物和后生动物之间的形态差异较大,并且RS头部组分的基因突变与表现为复发性气管炎、不育和内脏倒位等病征的原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)密切关联。以往对RS的研究主要应用冷冻电子断层重构(cryo-ET)技术,分辨率较低,并且主要集中在低等生物。虽然近期原生生物衣藻的RS结构研究取得进展,但尚无高分辨率的高等动物RS结构,制约了对纤毛摆动分子机制的理解。
科研人员在小鼠原代培养细胞中检测了RS同源蛋白的纤毛定位情况,结合体外生化实验发现小鼠RS头部复合体由Rsph1、Rsph3b、Rsph4a及Rsph9亚基组成,缺少Rsph6a和Rsph10b(其直系同源物存在于原生动物的RS头中),与衣藻中的组成成分差异较大,并且存在组织特异性表达(图A)。研究表明,在进化过程中,生物为适应不同条件下的运动环境产生了有一定差异的RS,进而产生了不同的纤毛摆动方式。
科研人员解析了鼠源RS头部复合体3.2埃分辨率的冷冻电镜结构,并开展了从头建模,此为首个高等动物RS头部复合体的原子结构(图B、C)。该结构呈二重对称的“刹车片”状结构,其中Rsph4a与Rsph9形成紧凑的“身体”,伸展着两个由Rsph1形成的扭曲状的长臂,同时可通过Rsph3b背侧连接到RS的茎部。研究发现,多种PCD致病性突变发生在可能对该复合体的组装或稳定性至关重要的位点(图D),可导致辐射轴头部组装异常,进而引起纤毛摆动异常。此外,结合多尺度结构信息的建模分析表明,RS头部可以通过齿状Rsph4a区域刚性地或通过其伸展的双臂弹性地接触CP的周期性突起(图E),以此优化RS-CP的相互作用和机械信号转导,进而精确控制纤毛的摆动。该研究首次解析了在高等动物纤毛运动中起关键作用的RS头部复合体的高分辨率冷冻电镜结构,阐明了辐射轴和中央微管附属结构的相互作用方式,为研究纤毛摆动的分子机制提供了重要的结构基础,并揭示了相关基因突变导致PCD的可能病因。
分子细胞卓越中心丛尧团队博士研究生郑伟,朱学良团队博士研究生李凡为论文共同第一作者;丛尧、朱学良和研究员鄢秀敏为论文共同通讯作者。该研究获得分子细胞卓越中心研究员鲍岚、李典范、周兆才以及清华大学教授潘俊敏的支持。研究工作得到国家科技部、国家自然科学基金委员会和中科院等的支持,并获得国家蛋白质科学研究(上海)设施的冷冻电镜系统、质谱系统、数据库与计算分析系统及蛋白质表达纯化系统的支持。
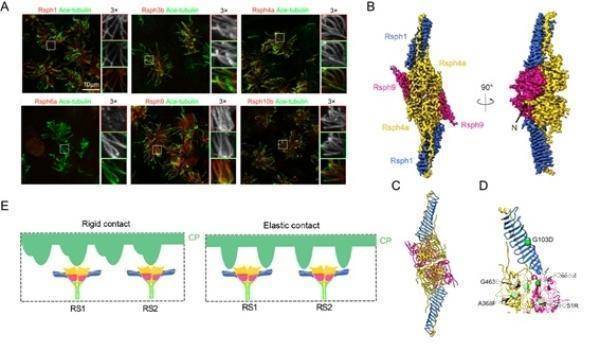 (A)mEPC的免疫荧光显示Rsph1,Rsph3b,Rsph4a,Rsph9和Rsph10b(而不是Rsph6a)位于纤毛轴突中。(B)、(C)RS头部复合体的3.2埃分辨率冷冻电镜结构及其原子模型。(D)已知引起PCD的突变mapping到原子模型上。绿色球代表与PCD相关的突变。(E)RS头部与中央微管附属结构相互作用的两种可能模式。
(A)mEPC的免疫荧光显示Rsph1,Rsph3b,Rsph4a,Rsph9和Rsph10b(而不是Rsph6a)位于纤毛轴突中。(B)、(C)RS头部复合体的3.2埃分辨率冷冻电镜结构及其原子模型。(D)已知引起PCD的突变mapping到原子模型上。绿色球代表与PCD相关的突变。(E)RS头部与中央微管附属结构相互作用的两种可能模式。
原文链接:http://www.cas.cn/syky/202102/t20210207_4777510.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

干货 | 美国空军实验室综述:高熵合金的特点及其研究现状

周军课题组揭示纤毛稳态调控的新机制
纤毛发生起始机制研究取得进展

静力试验中C/SiC构件集成式热结构的声发射特性及与材料测试的对比
RS-68火箭发动机

【复材资讯】形状记忆聚合物微纳米纤维膜在生物医学中的应用进展

这辆奥迪RS,丐版兰博基尼
分子细胞卓越中心发现衰老与纤毛之间的相互作用机制
MA-RS法

新型机器人可编织玻璃纤维结构