科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-06
来源:BioArt
撰文 | 章台柳
驱动肿瘤转移的分子机制研究已经有很多,但是转移如何进入特定的器官,尤其是大脑,目前尚不清楚。肿瘤的脑转移发生率是所有原发性脑肿瘤的10倍。脑转移常见于肺癌和乳腺癌,预后差、死亡率高,缺乏有效的治疗【1】。事实上,脑部微环境不利于肿瘤的散播,转移效率较低。具有重塑大脑生态支持生存和生长能力的肿瘤细胞才能够成功转移定植【2】。肿瘤来源的外泌体是细胞间通讯的关键因素,能够重塑远处的微环境,如转移前的niches、驱动器官特异性转移【3】。因此,需要对肿瘤内在的特性、肿瘤细胞和脑部微环境间相互作用进行研究,以鉴定出预防和治疗脑转移的靶点。
2019年11月4日,来自美国康奈尔的David Lyden、David Pisapia和Maria de Sousa在Nature Cell Biology杂志发表文章Tumour exosomal CEMIP protein promotes cancer cell colonization in brain metastasis,报道了肿瘤外泌体对脑转移定植的影响,证明脑转移肿瘤的外泌体预处理脑部微环境促进肿瘤细胞生长。外泌体蛋白CEMIP增加只发生在脑转移肿瘤,而不发生于肺转移和骨转移肿瘤。敲除肿瘤细胞的CEMIP抑制脑转移、破坏肿瘤侵袭、肿瘤细胞和脑血管的作用;使用CEMIP+外泌体预处理脑部微环境则逆转该表型。摄取了CEMIP+外泌体的脑内皮细胞和小胶质细胞通过上调促炎基因如Ptgs、Tnf、Ccl/Cxcl,诱导血管周围的内皮细胞分支和炎症反应。同时,脑转移病人的肿瘤组织和外泌体中CEMIP升高,能够预测脑转移进展和病人的生存期。

研究人员分别使用人转移性乳腺癌的脑转移型、肺转移型、骨转移型和原位型来源的外泌体对器官型脑切片进行共孵育,随后加入脑转移型癌细胞。结果显示脑转移型来源的外泌体预处理显著增加脑转移型癌细胞的定植和生长,并且增强侵袭性和增殖能力。此外,脑转移型来源的外泌体预处理增强脑转移能力较差的原位癌细胞定植。使用定量质谱对各来源的外泌体的蛋白进行测量,脑转移型和原位型外泌体仅有20种蛋白差异性表达,其中CEMIP仅在脑转移型表达,在骨转移型、肺转移型、原位型均无表达,具有脑转移型特异性。CEMIP参与透明质酸解聚、细胞内钙调控和Wnt信号的传导,在癌症进展、炎症和正常脑生理钟发挥多种作用。脑转移型外泌体的CEMIP的丰度较高,而且比脑转移型癌细胞高10倍,提示外泌体的选择型包装。

那么,外泌体蛋白CEMIP如何发挥作用,促进癌症的脑转移?在脑转移型癌细胞中敲除CEMIP,对外泌体的大小和形态、外泌体的蛋白包装系统都没有影响。CEMIP KO细胞具有正常的增殖和侵袭能力,但失去了脑转移型的梭状形态,呈圆形,而且与脑血管关联的能力明显受损,癌细胞的脑侵袭下降50%。使用CEMIP+外泌体预处理则恢复CEMIP KO癌细胞与血管的关联及梭状形态,增加脑侵袭。小鼠的肿瘤转移膜型实验显示,4周内,CEMIP缺失的癌细胞发生脑转移的概率显著下降,脑转移灶下降70%,转移负荷显著下调;但单个转移肿瘤大小没有差异,CEMIP对转移定植的早期有重要作用。CEMIP+外泌体的预处理显著增加脑转移,转移灶和转移负荷都增加。
荧光定位显示,外泌体主要和CD31+、Glut1+内皮细胞共定位,部分与Iba+小胶质细胞共定位,少量与GFAP+星形胶质细胞、NeuN+神经元共定位。CEMIP+外泌体促进内皮管形成,增加内皮细胞分支的数量和大小,对脑血管进行重塑。进一步对内皮细胞和小胶质细胞进行转录组测序,外泌体的预处理导致286个内皮细胞基因和193个小胶质细胞基因发生变化,其中分别有119个、25个是依赖于CEMIP的。内皮细胞中,CEMIP依赖的基因主要与炎症反应、血管形态发生和淋巴管生成有关,而且主要影响肌醇相关通路(CEMIP通过控制胞内钙的释放进行调节)、骨关节炎、间隙连接、粘附分子等,与血管重塑和内皮细胞间作用相关。小胶质细胞中,CEMIP依赖的基因主要与炎症、免疫调节、神经炎症相关。
最后,研究人员对超过300个原位肿瘤和具有脑转移的乳腺癌和肺癌病人的转移性肿瘤样本进行检测,肿瘤的CEMIP表达与癌旁组织相比显著上调。脑转移病人的CEMIP表达显著升高;相比于其他器官的转移,脑转移表达更高的CEMIP,超过40%的脑转移是CEMIPhigh型,而非脑转移仅有7%。对于已经发生脑转移的病人,原位癌细胞表达更高的CEMIP,则其转移期更短。而且,CEMIPhigh脑转移的病人生存期更短。
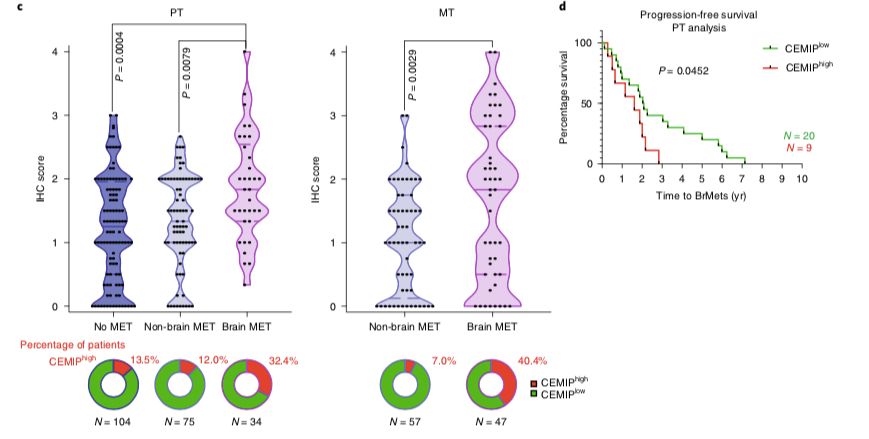
总的来说,研究揭示了外泌体蛋白CEMIP能够作用于脑血管和小胶质细胞,重塑脑部微环境,促进癌细胞的脑转移,并在病人样本中验证了CEMIP的高表达和病人脑转移期端、生存较差有关,提示了靶向外泌体CEMIP或将成为脑转移防治的新途径。
原文链接:
https://doi.org/10.1038/s41556-019-0404-4
参考文献
1. Eichler, A. F. etal. The biology of brain metastases—translation to new therapies. Nat. Rev.Clin. Oncol. 8, 344–356 (2011).
2. Sevenich, L. etal. Analysis of tumour- and stroma-supplied proteolytic networks reveals abrain-metastasis-promoting role for cathepsin S. Nat. Cell Biol. 16,876–888 (2014).
3. Hoshino, A. et al. Tumour exosome integrins determineorganotropic metastasis. Nature 527, 329–335 (2015).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478604&idx=6&sn=25834997157e1dd2a32df88ff40ff9b7&chksm=84e20f38b395862e6a287a9dc767c135b007b5b50805e85e7e5df593b4d29043c12f3bc35ebc&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
角膜内皮细胞计数仪

新研究:癌细胞形成肿瘤离不开线粒体
癌细胞竟成抗癌先锋:杀遍全身肿瘤再乖乖自杀


Cell :小鼠内皮细胞单细胞图谱
癌症演化树:揭示癌症转移机制


学者发现治疗非小细胞肺癌新方法

Cell:外泌体中的PD-L1可协助肿瘤细胞进行免疫逃逸
肿瘤疯狂消耗人体营养,“祸首”并非癌细胞



难怪肿瘤长得快!宗晖教授团队《细胞》发文,揭示癌细胞“偷换身份”促生长

人类对癌症的基本认知被推翻:肿瘤疯狂消耗葡萄糖,“祸首”并非癌细胞