科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-14
来源:环球科学
发热,周期性地反复发热——在中国上海和加拿大安大略省,5名患者经受着同样的痛苦,却一直查不出病因。幸运的是,他们的基因数据被送往浙江大学生命科学研究院周青实验室进行了研究。经研究发现,这是一种由RIPK1基因突变引起的自身炎症性疾病(Autoinflammatory Disease, AID)。周青及其合作团队对致病机制进行了解析,并在此基础上对患者进行了卓有成效的治疗。
在此之前,从未有研究报道这一基因突变引起的人类自身炎症性疾病。研究首次发现了人类RIPK1蛋白在其重要的切割位点的变异对调控细胞凋亡、坏死等重要信号通路及人类健康的影响。这将为开展个体化诊疗,特别是罕见的自身炎症性疾病提供更加精准的参考信息。

2019年12月12日(北京时间),研究论文“A dominant autoinflammatory disease caused by non-cleavable variants of RIPK1”在Nature上线,周青实验室博士生陶攀峰、王俊和王诗豪博士为共同第一作者,浙江大学生命科学研究院周青研究员、哈佛大学医学院袁钧英教授、复旦大学附属儿科医院王晓川教授、俞晓敏博士为论文通讯作者。
“无名”的炎症
2018年上海复旦大学附属儿科医院免疫科的一位两岁的小病人,在没有感染的情况下,每周一次的规律性发烧,伴有淋巴结肿大。然而,一系列“阴性”的检测结果让诊断变得困难。“有可能是一种未被鉴定的自身炎症性疾病。”接诊的王晓川教授临床经验丰富,他将这个病例和家系的基因组数据交给周青实验室进一步分析。巧的是,周青实验室又收到4个来自加拿大的病例,患病的是一位35岁的母亲和她的3个孩子,症状与上海复旦患儿十分相似。
发热是机体炎症的一种表现,是人体应对病毒入侵的一种自我保护机制。但是,自身炎症性疾病则是在没有感染的情况下人体免疫系统自动激活,自发产生炎症,给患者带来巨大痛苦。“这是一个强有力的提示,可能是患者的某个基因发生了突变,导致免疫系统的异常激活。”周青说。
在浙江大学,周青研究团队着手对患者的全外显子测序数据进行生物信息学与遗传学分析,试图“揪出”那个隐藏在海量基因组数据中的突变基因。
这是周青实验室的擅长。9年前,周青在《新英格兰医学杂志》上读到一篇论文,美国国立卫生研究院Daniel Kastner教授发现了一种新的自身炎症性疾病DIRA,阐明了发病的分子机制,并治愈了出生就患有非常严重的炎症疾病的小婴儿,彻底改变了患儿的命运。“读到那篇论文后我特别激动,我也要做这样的研究!”后来,周青申请到了Daniel Kastner实验室的博士后职位。期间,她还获得了美国医学遗传学与基因组学学会(ABMGG)认证的临床分子遗传学执业主任医师执照 (DABMGG)。

图:在美国国立人类基因组研究所工作期间的师友给周青的照片与留言。
多年来,周青的研究从临床中来又应用于临床,经她发现鉴定的自身炎症性疾病的新致病基因有导致早发性中风和血管病变的基因CECR1(DADA2),导致早发性白塞氏病的基因TNFAIP3,导致OTULIPENIA疾病的基因OTULIN,导致自身免疫疾病和免疫缺陷的基因PLCG2等多个基因。通过解析这些疾病背后的分子机制并指导临床治疗,成百上千个被自身炎症性疾病折磨的病人过上了曾经奢望的健康生活。“每次鉴定到一个新致病基因,我晚上就会激动得睡不着!”,周青说。
“RIPK1基因,突变位点p.Asp324。”两个月后,上海病人的致病基因找到了,加拿大病人也发生了同样的基因突变——RIPK1蛋白的一个极其重要的功能位点发生了突变。“这次我们尤其幸运,仅通过两个家系就定位到了致病基因。”周青说,“接下来需要进一步揭示其致病机理,希望对临床治疗提供指导性方案。”
“狙击”炎症本源
生命体的基因突变时有发生,但其中大部分并没有“致病”作用,只有极少数基因突变会影响细胞的正常生理活动,带来严重的疾病表型,它们多半是影响了某些重要代谢通路或生理反应的重要环节;如果这样的基因突变发生在生殖细胞,将会通过父母遗传给孩子,成为遗传病,我们所熟知的红绿色盲、血友病、白化病等,都是单个基因突变造成的遗传病。自身炎症性疾病是遗传疾病中的一个大类,患者体内调控炎症反应或免疫细胞的基因发生突变,导致自身免疫系统被异常激活,引起“非感染性”炎症。
周青说,RIPK1是受体相互作用蛋白(RIP)激酶家族的一种。它参与了决定细胞命运的多种重要信号通路,地位十分重要。哈佛大学袁钧瑛等科学家曾发现,RIPK1调节着细胞的凋亡和程序性坏死。
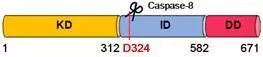
图:RIPK1蛋白模式图及突变位点
“发生突变的地方恰好是RIPK1受到蛋白酶Caspase-8切割的位点,正常情况下,被切割的RIPK1将不再有被激活的能力。”周青说,“突变以后,RIPK1就变得不可切割,这样一来,它就持续处于激活的状态,在某种程度上促进了细胞的凋亡和程序性坏死。”研究者进一步发现,在患者的外周血单核细胞(PBMC)中, IL-6、TNF等炎症因子异常升高。“基因突变导致了更多PBMC细胞的凋亡和坏死,而细胞的凋亡与坏死激活了炎症因子的释放,而炎症因子又进一步促进了细胞的死亡,这是一个恶性循环,引发周期性发烧等一系列临床症状。”周青说。
这是科学界第一次鉴定到RIPK1非切割变异导致的自身炎症性疾病。“明晰了致病机理,我们就可以找到办法精准‘消炎’。”周青介绍,研究团队根据致病机制的研究结果,建议临床医生对患者使用抑制炎症因子IL-6受体的药物tocilizumab,几个月后患者的炎症表型渐渐消退,治疗效果明显。
确诊更多病例
很快,“人类孟德尔遗传”数据库(Online Mendelian Inheritance in Man,OMIM)——一个全球范围内持续更新的关于人类基因和遗传紊乱的数据库——将收录由于RIPK1非切割突变导致的自身炎症疾病这一病种。

世界各地的医生和研究人员可以在网上查看这篇研究论文、病例数据和治疗方案。“虽然鉴定时是个别病例,但是随着病种被报道,更多未被确诊的病例有可能会得到确诊。随着病例的增加,人们对于这种疾病将会有更深入的理解。”周青说。周青曾在2014年根据8个家系9个病人的遗传信息鉴定出一种名为DADA2的自身炎症疾病,到目前为止,这种疾病在全球范围内已发现超过400例。

图:2018年召开的第二届DADA2国际会议期间,全球确诊的93个DADA2病人也参加了此次会议
在人群中的发病率低于十万分之一的疾病被定义为罕见病,自身炎症性疾病属于罕见病。如果足够幸运,患者可以确诊并得到及时治疗。周青去年诊断过一位患有DADA2病的小男孩,“5岁的小男孩当时有高血压和发烧,幸亏得到了及时的确诊和治疗,不然可能会发生多次中风。”周青说,“好多自身炎症性病人因为我们的研究找到新的致病基因,从而使他们被确诊,得到了精准的对症治疗,甚至从ICU被救了回来,那对研究者来说是一种莫大的鼓舞。”
但是,大多数自身炎症性疾病的患者并没有如此幸运。他们从发病到被明确诊断的平均时间是7年。遗传病的遗传诊断率为40%左右。“也就是说,大部分遗传病我们还不知道其发病原因,也找不到治疗方案。”周青说。她曾遇到过一个来自沙特阿拉伯的病人,6岁的小病人在全世界看过100多个医生,就是找不到病因,“最后在我这里得到了明确的遗传诊断,并且当时是个新的致病基因。”“自身炎症性疾病目前已知的有近四十种,如果都加起来,患病个体数量是非常庞大的。但是目前,大量的自身炎症性疾病病人在被漏诊错诊。”周青说。
这就是科学家们感到任务紧迫的原因。在浙江大学,周青建立了自己的疾病样本库,并与全国乃至世界各地的医疗机构建立了联系。她时刻在等待,新出现的病例能够尽早在大量相似类型的疾病样本库中找到“配对”,帮助医生和病人“侦破”病因。
“希望临床医生在碰到周期性发烧的病人,但是又无法确诊的情况下与我联系,我们研究团队会尽一切可能帮助病人找到致病基因,帮助医生进行诊断和治疗。”
周青说,“在接下来的几年里,我们将争取鉴定更多的新致病基因,为人类遗传病诊断和治疗做出贡献。”
来源:huanqiukexue 环球科学
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NDA1Njg2MA==&mid=2651998784&idx=2&sn=f3c61c2a3d7deba1f6e932e527606ae1&chksm=bd6b75b38a1cfca51e7574f01225c051bb9001801327d05d6f2faad0390824e2e847c42dc11d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

单基因突变与人类肥胖有关

基因突变让你不辨“鱼腥”
eLife:基因突变协同让肺癌更恶性!
真相:桃子和西瓜一起吃有剧毒?谣言卷土重来,你又信了?

单基因突变与人类肥胖有关
基因突变揭示为何有人不得新冠

Nat Commun:癌症——基因突变的起源
石远凯:探索抗癌新药

Nature Neuroscience :发现罕见基因突变
趣味科学:仰卧起坐会导致瘫痪,这是真的吗?