科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-15
来源:X一MOL资讯
在过去的十几年中,以癌症代谢为治疗靶点的药物干预引起了人们较大的兴趣。例如饥饿疗法,可通过葡萄糖氧化酶消耗外源葡萄糖,阻断肿瘤的能量供应,从而促进肿瘤治疗。然而,仅仅通过消耗葡萄糖并不能完全阻断肿瘤能量(主要是ATP)的供应。其他替代能源物质,如乳酸、谷氨酰胺、丙酮酸,仍然可以为肿瘤细胞增殖提供能量。
氧化磷酸化(OXPHOS)是细胞能量代谢的下游反应。可通过一氧化碳(CO)破坏线粒体电子传递链(ETC),使OXPHOS解耦联,彻底阻断ATP产生。但CO在正常组织中的非特异性释放会降低肿瘤细胞中CO浓度,导致代谢和氧化还原适应,最终产生耐药性。目前文献中已经报道了一些方法克服上述不足,但高效特异性CO释放平台的开发仍然是一个巨大的挑战。
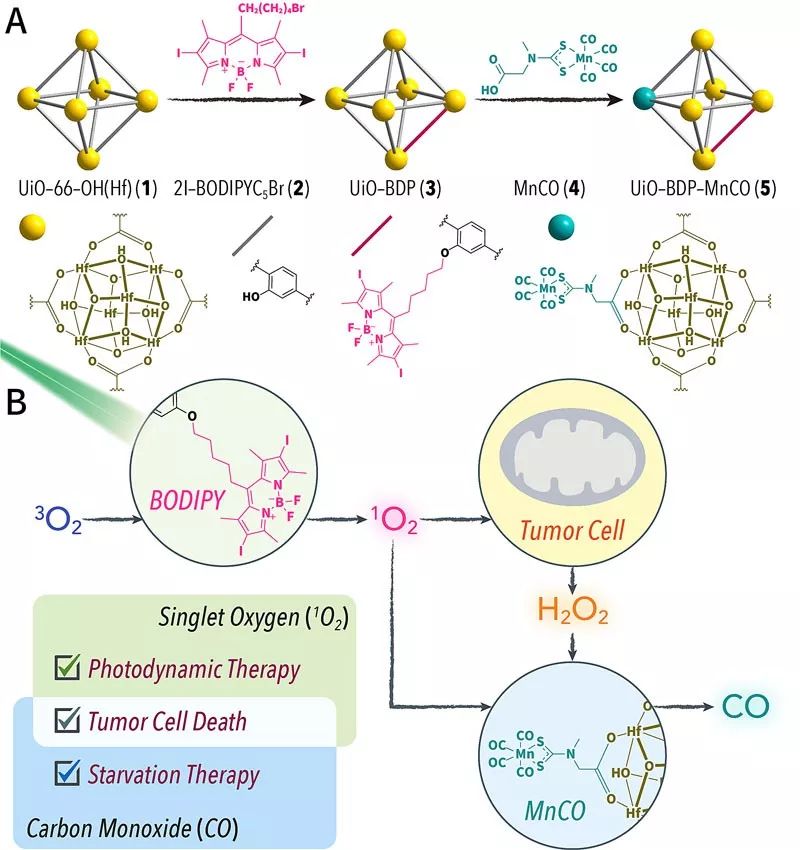
图1 材料设计与级联反应。(A)通过两步后修饰在UiO-66-OH(Hf)纳米MOF平台上加载2I-BODIPY光敏剂和CO前药MnCO。(B)光触发的细胞内级联反应产生1O2和CO诱导细胞死亡。
最近,山东师范大学董育斌课题组设计了基于级联反应的光动力治疗(PDT)和CO释放平台。在纳米尺度金属-有机框架(NMOF)上通过2I-BODIPY、羰基锰化合物的两步后修饰,获得了UiO-BDP-MnCO复合纳米材料。在特定光照射下,PDT产生的1O2可以激活肿瘤细胞中的线粒体氧化应激,从而导致细胞内活性氧(ROS)上调。产生的ROS(例如H2O2和1O2)可以触发MnCO分解释放CO。PDT和释放的CO都会不可逆地损害肿瘤细胞的线粒体,进而诱导细胞死亡。而细胞内源性的氧化物质却不能氧化羰基锰化合物释放CO。由于这种细胞内级联反应引起的CO释放只会发生在光照区域,可以有效避免CO的副作用。该NMOF体系表现出良好的细胞和活体治疗效果,为更加精确和高效的肿瘤治疗提供了新的研究思路。
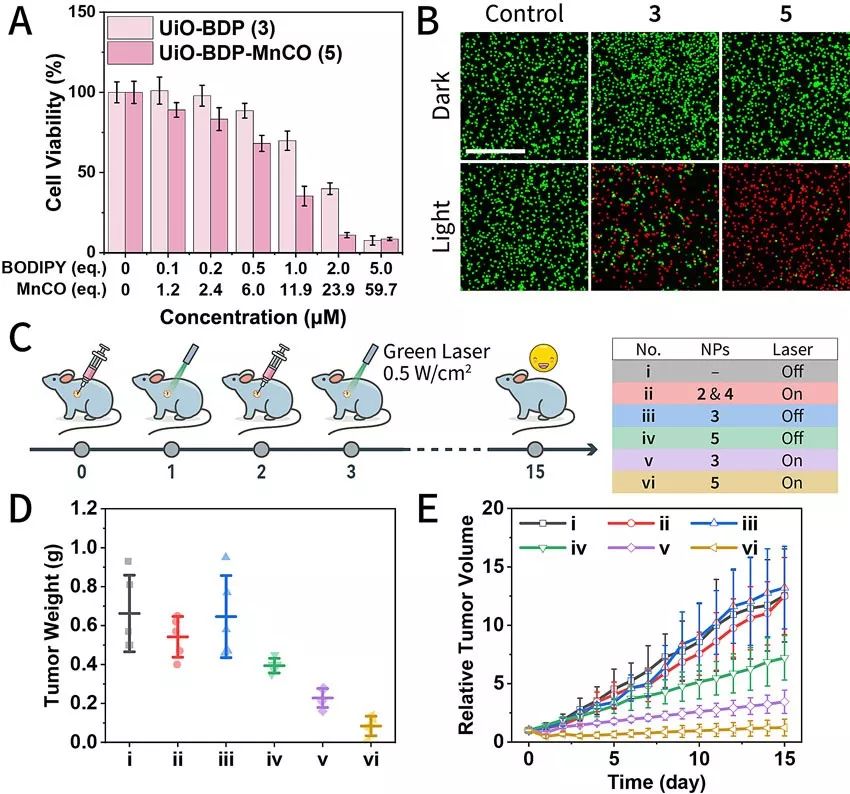
图2 细胞和活体的治疗效果。(A) 细胞MTT实验评估不同处理条件下的细胞活力。(B) Calcein-AM/PI双染色直观地检测细胞存活情况。(C–E) 在异种移植物乳腺癌肿瘤模型中验证PDT与CO联合治疗的可行性。
这一成果近期发表在Chem. Commun.上,并被选为Back Cover,文章的第一作者为山东师范大学化学化工与材料科学学院的博士生官群,通讯作者为李延安副教授和董育斌教授。

来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657625153&idx=7&sn=34fa73d7d329f053b8769fad65d99423&chksm=80f80d91b78f8487709fd4824cfa6ab4eb54244e921d91eb3f04534505ca0f11240c09a3ab4a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国抗癌协会肿瘤护理专业委员会在津成立




【有益思】科学家揭示黄连素调节能量代谢机制
热烈祝贺中国光学学会常务理事顾瑛教授和姜会林教授当选院士

Plant Cell : TOR激酶,一个调节植物能量代谢重要蛋白
中国抗癌协会肿瘤介入学专业委员会换届会议召开



Nature Metabolism:关于乳酸与能量代谢关系的研究

【走近桂籍科学家】用纳米武装电池新世界
JMCB观点文章 :解读外周生物时钟和能量代谢的整合机制
中国—奥地利纳米科技及新材料研讨和对接洽谈会在深圳举行




EMBO R :宋质银/吴志达揭示低氧下结直肠肿瘤能量代谢重编程新机制