科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-05-27
2021年5月26日,Nature 杂志在线发表了美国霍华德-休斯医学研究所/耶鲁大学John MacMicking团队的题为A phase-separated nuclear GBPL circuit controls immunity in plants的研究论文,发现植物GBPLS超家族的两个成员GBPL1和GBPL3,通过相变行为在细胞核内组装LLP驱动的缩合物。该“相变开关”调动了宿主对病原体侵染后的免疫反应,从而实现宿主防御。

细胞是生物体结构和功能的基本单位。为了细胞中各种生物化学反应的快速高效完成,细胞进化出了一系列的细胞器,包括有膜包裹的(比如线粒体,细胞核,溶酶体等)和无膜包裹的细胞器(核仁等)。有膜包裹的细胞器将特定蛋白、核酸等物质包裹起来,以在特定的空间内执行其功能。这些无膜细胞器没有细胞膜包裹,但是仍能稳定存在,并与周围环境产生频繁的分子交换。无膜细胞器如何形成以及其物理化学本质,是困扰了大家多年的问题。
液-液相分离(liquid–liquid phase separation, LLPS)提供了一个形成此类细胞器的机制:某些蛋白质或者核酸分子可以通过多价相互作用,在原本均一的环境中产生物理化学性质不同的另一相,形成无膜细胞器或者是细胞结构。在绝大多数情况下,这些细胞结构呈现液态特征,所以被称为液滴(liquid droplet)或者是液态凝聚体(liquid condensates)。LLPS已经成为理解真核生物中无膜细胞器如何区域化划分不同细胞活动的基本范式。
近3年来,植物领域已经发表了5篇Cell、Nature论文,报道了相分离在植物中的功能。
1. 2018年1月,德国马普生化所Manajit Hayer-Hartl课题组在Nature杂志在线发表了题为Rubisco condensate formation by CcmM in β-carboxysome biogenesis 的研究论文,报导了Rubisco-CcmM复合物结构,并且通过生理实验验证了Rubisco在β-羧酶体生物发生过程中由CcmM介导的相变过程的分子机制。表明,Rubisco的液体状缩合物的形成是通过与SSUL结构域的动态相互作用介导的,而不是通过低复杂性序列介导的。
2. 2019年2月,宾夕法尼亚大学Alison M. Sweeney研究组在Cell 上发表题为Pollen Cell Wall Patterns Form from Modulated Phases 的研究论文。该研究根据花粉表面多糖中可能存在的非稳态的相分离特性对于不同植物花粉表面的多样性进行分析,建立了一个统一的物理学模型。
3. 2019年5月,英国 John Innes Centre的Caroline Dean研究组与清华大学李丕龙研究组合作在Nature发表题为Arabidopsis FLL2 promotes liquid-liquid phase separation of polyadenylation complexes 的研究论文。发现coiled-coil蛋白FLL2介导拟南芥开花的关键蛋白FCA的nuclear bodies的形成。
4. 2020年3月,中国科学院植物研究所/河南大学生命科学学院张立新教授研究团队在Cell 发表了题为Liquid-Liquid Phase Transition Drives Intra-chloroplast Cargo Sorting的研究论文,首次提出并阐明了相分离驱动叶绿体内蛋白分选的新机制。该研究发现了位于叶绿体基质的关键蛋白转运分选因子STT1与STT2,阐明了双精氨酸依赖转运途径的底物识别、分选以及转运靶定到双精氨酸依赖转运途径的分子机制。对于探讨叶绿体的生物发生、光合器官的建成和功能调节以及真核生物的起源和进化等都具有重要的意义。
5. 2020年8月,英国剑桥大学Philip Wigge团队在Nature在线发表了一篇题为A prion-like domain in ELF3 functions as a thermosensor in Arabidopsis的研究论文。该研究发现拟南芥ELF3通过PrD(prion-like domain)介导的相变感受环境温度变化,使ELF3成为一个新的热感受器。
本研究,作者发现了一个植物GBPLS超家族(guanylate-binding protein (GBP)-like GTPases (GBPLs),它们在细胞核内组装LLP驱动的缩合物,以保护细胞免受感染和触发植物免疫。 在拟南芥中,这个家族的两个成员:GBPL1和GBPL3,经历相变行为来控制转录反应,是生物胁迫触发的变构开关的一部分。GBPL1是一种假GTP酶,在基础条件下隔离催化活性的GBPL3,但在免疫信号作用下进入细胞核时被GBPL3 LLP取代,从而驱动独特的无膜细胞器的形成,称为GBPL防御激活的缩合物(GDACs),原位冷冻电子断层扫描中也观察到了这一变化。在这些GDAC结构中,天然的GBPL3直接与防御基因启动子结合,并招募介体复合体和RNA聚合酶II机制的特定转录共激活因子来大规模重新编程宿主基因的表达以达到抗病的目标。
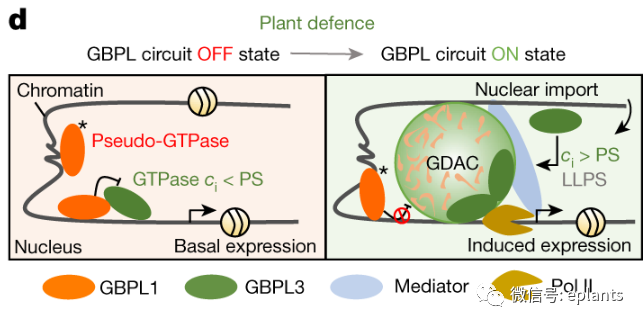
综上,该研究确定了一个GBPL的调控回路,GBPL1-GBPL3回路包含一个GTPase-伪GTPase变构开关,激素和代谢信号在感染后不久激活了这一开关,导致GBPL3驱动的免疫缩合物的快速形成。该开关控制宿主对病原体的转录反应,以实现宿主防御,它是植物防御中不可或缺的角色。同时,这种活性也在其他物种的GBPL中观察到,这表明这个GTPase超家族的LLP行为在植物中也具有其他的生物学功能。
来源:植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247497623&idx=3&sn=e0087c9ac4e33ce23731d797b2b64bae
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
HIV通过“绑架”细胞表面分子入侵细胞

“促癌黑手”Ter细胞首次发现

《细胞》子刊:卡路里限制可以增加干细胞数量,加剧细胞之间的竞争,淘汰基因突变细胞

“基因剪刀”让皮肤细胞“变身”干细胞

学术造假必遭严惩,为何仍不断有人冒险

人工细胞与生物细胞首次实现成功融合与协作

神奇的“万能细胞”——干细胞
“细胞食物”揭示T细胞代谢途径
Science提出新观点:不仅免疫细胞,正常细胞也能杀死癌细胞!
《细胞》发文!阿片类药物迎来重大突破