科技工作者之家
加好友
科技工作者之家 2021-10-05
尽管2型糖尿病(T2DM)的治疗在过去几十年取得了令人瞩目的进展,但科研人员探索新型治疗方法的脚步从未停歇。如何更好地控制血糖、减少糖尿病相关并发症成为T2DM研究领域的热点话题。近日,《柳叶刀-糖尿病与内分泌学》(The Lancet Diabetes Endocrinology)发表了深度综述文章,详细介绍了T2DM的新型治疗靶点、药物作用机制以及相应的降糖疗效,其中涉及传统胰岛素的创新探索以及其他大量正在在研的新型药物。
近年来全球T2DM的患病率呈现迅速增长,已经成为一个全球性的严重公共卫生问题。T2DM治疗的近期目标是控制高血糖,因此降糖治疗是T2DM患者管理的主要治疗措施。
此外,通过健康生活方式干预,并结合其他药物预防糖尿病治疗相关并发症,将有助于提高T2DM患者的生命质量和延长寿命。
值得关注的是,伴随着大量创新治疗手段的成功应用,如持续血糖监测、胰岛素泵、口服降糖药钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂、注射类胰高血糖素样肽-1(GLP-1)受体激动剂等,血糖管理良好达标的患者比例却并未如想象中上升,这可能部分受药物可及性、患者受教育程度以及患者主观能动性等因素影响,而通过改善降糖药物疗效、减少药物相关严重副作用(如体重增长、糖尿病低血糖症等)等,对治疗进行创新或将有助于克服当前T2DM的治疗困境。
T2DM治疗前沿热点 ▪ 胰岛素制剂的创新 尽管今年距离胰岛素发现已有100周年,但科学家们针对胰岛素剂型、注射设备、疗效以及安全性等的探索却尚未停止。
Icodec胰岛素是一种新型的长效基础胰岛素类似物,可与白蛋白紧密但可逆的结合在一起,从而连续、缓慢且稳定地降低血糖。
基于其浓缩配方,icodec胰岛素可实现T2DM患者每周一次注射用药,且在血糖控制和安全性方面与每日注射一次的甘精胰岛素U100类似。
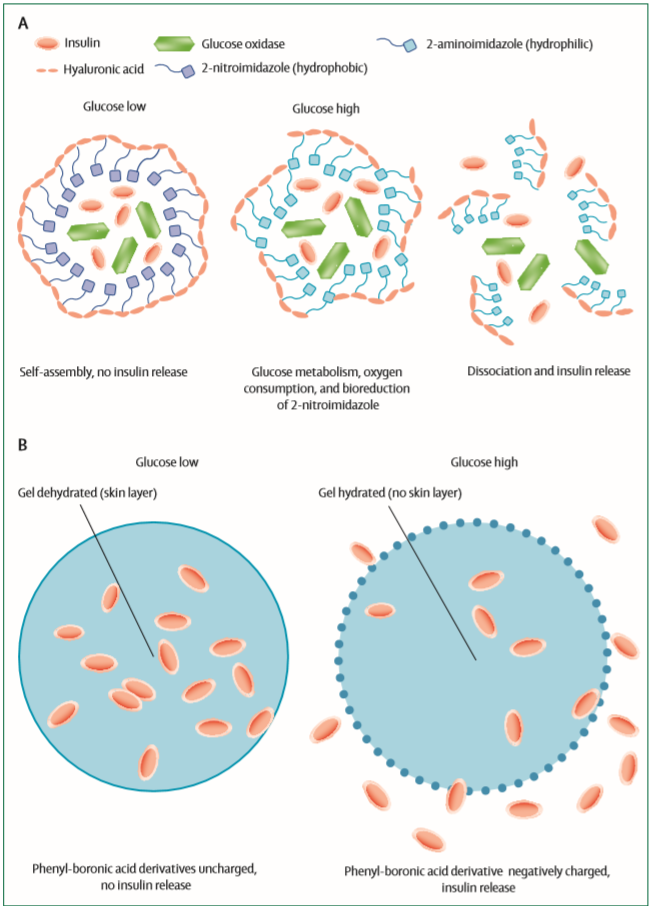
在胰岛素的“智能”递送方面,最新探索包括连接糖结构的胰岛素类似物(如MK-2640)和葡萄糖反应性皮下胰岛素递送装置。
前者可与胰岛素受体结合发挥降糖作用,也可与甘露糖受体结合导致自身的降解清除;后者基于葡萄糖反应性小囊或苯硼酸-葡萄糖配合物凝胶微球,可实现在高血糖时调节胰岛素的释放。
“智能胰岛素”是未来胰岛素发展的方向,但目前仍处于早期探索阶段。
两类葡萄糖反应性皮下胰岛素递送装置(A和B分别基于葡萄糖反应性小囊或凝胶微球在高血糖时调节胰岛素的释放) ▪ 挑战胰岛素抵抗生力军脂联素Adiponectin是由脂肪细胞分泌的一种蛋白质,与胰岛素抵抗和肥胖有着密切的联系。
体内及体外实验证实,脂联素具有抗动脉粥样硬化、抗糖尿病、抗炎的作用,可以阻止糖尿病和心血管疾病的进展。
文章指出,当前多项针对Adiponectin及其衍生物的药物研究(如PPARγ激动剂等)正在开展,不同疗法所观察到的降糖程度各有所异,但目前这些研究都尚处于临床前阶段。
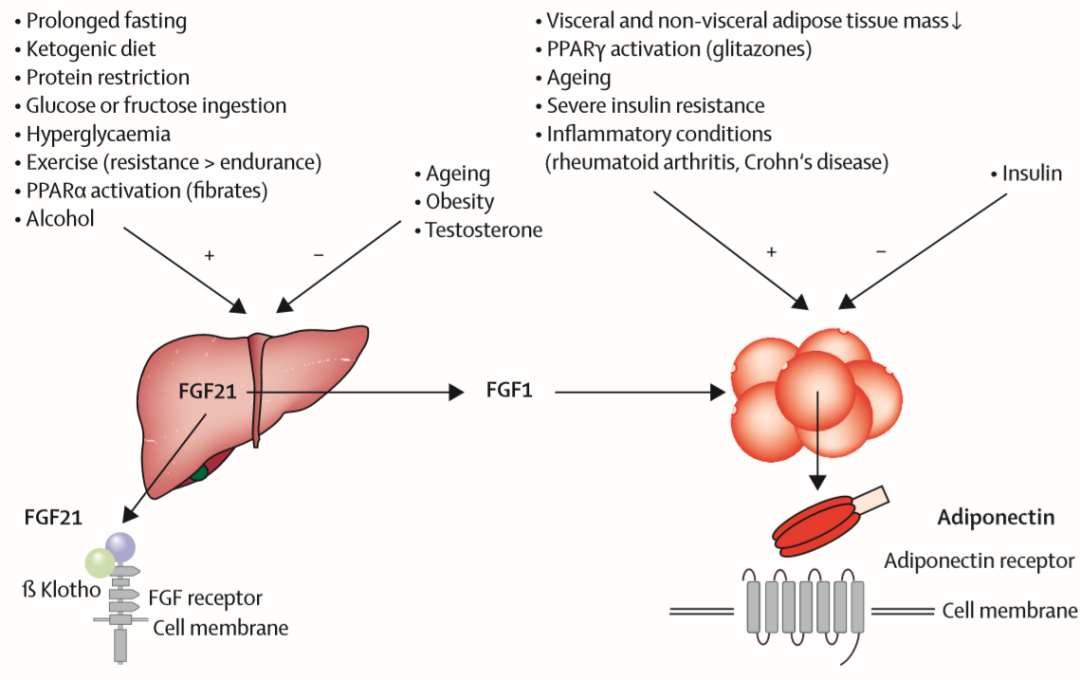
脂联素Adiponectin与FGF-21在T2DM中的作用机制 成纤维细胞生长因子(FGF)-21主要由肝脏分泌,长期以来被认为是一种调节脂肪代谢和葡萄糖代谢以及调控胰岛素敏感性的内分泌因子。
值得一提的是,脂联素Adiponectin的分泌主要由FGF-21及其衍生物激活。
临床前研究表明,对于肥胖以及胰岛素抵抗的模型小鼠,外源性FGF-21依然可发挥降低血糖和体重的作用。
目前FGF21及其类似结构药物(如LY2405319、PF-05231023、BMS-986036以及AKR-001等)在1期与2期临床试验中也已经展现出疗效,尽管在人体中的疗效结果与动物模型存在差异,但未来探索值得期待。
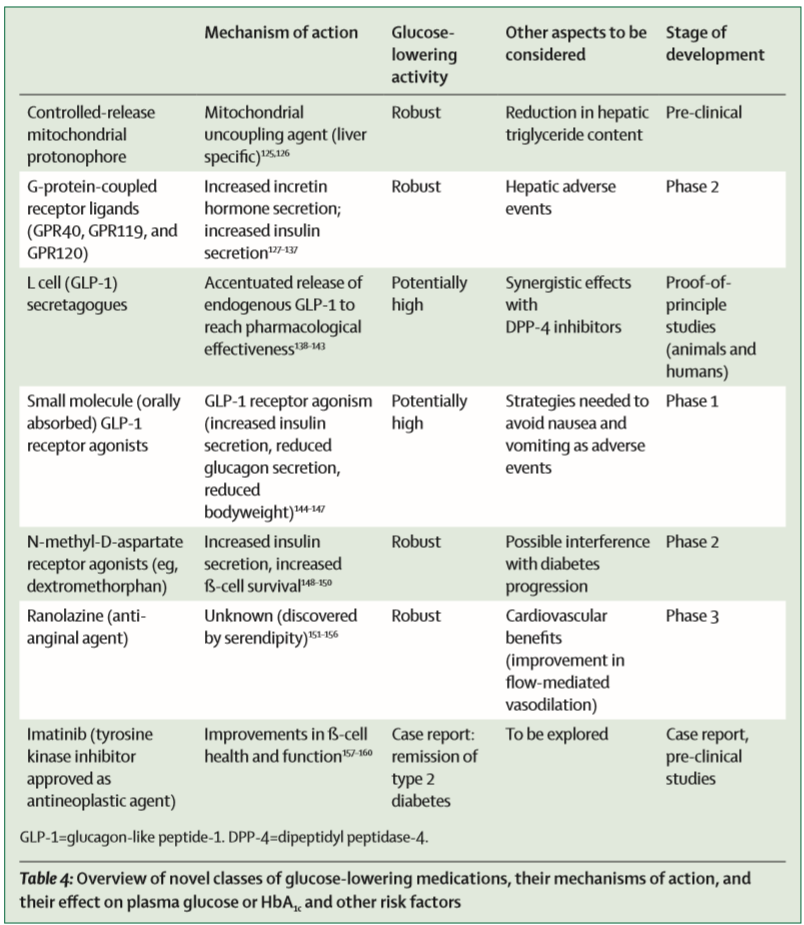
文章指出,除脂肪细胞因子Adiponectin和肝细胞因子FGF-21外,小分子口服GLP-1受体激动剂、GLP-1促泌剂以及以线粒体生物能量学为靶点的创新药物imeglimin等在T2DM的治疗中同样前景可期。
与此同时,如何避免T2DM治疗过程中相关副作用或并发症的出现也是未来需要面临的挑战。
T2DM创新药物作用机制及相关风险因素(图片来源:参考资料) GLP-1受体激动剂属于肠促胰岛素类药物,能带来减轻体重、降低收缩压、改善血脂谱等降糖外的额外获益,而诸如LEADER、SUSTAIN-6以及REWIND等研究的结果表明,GLP-1受体激动剂的应用或可预防T2DM患者中肾脏相关不良事件的发生。
小分子口服GLP-1受体激动剂理论上将更加容易被糖尿病患者吸收,在临床前动物模型中,小分子口服GLP-1受体激动剂以葡萄糖依赖的形式对胰岛β细胞cAMP水平进行调控,并刺激胰岛素分泌、降低血糖,这类药物在人体试验中的药代动力学研究数据值得期待。
此外,GLP-1促泌剂可通过刺激肠道L细胞对GLP-1的分泌发挥作用,临床前研究显示,GLP-1促泌剂类药物可改善试验动物的糖耐量异常。
Imeglimin是以二甲双胍为前体合成的小分子药物,目前已经在日本获批用于T2DM的治疗。
Imeglimin有望通过改善胰岛β细胞的胰岛素分泌、增强胰岛素敏感性、预防高脂饮食诱导的胰岛素抵抗以及抑制肝脏糖异生来发挥降低血糖的作用。
此外,减重手术带来的肠道激素环境的变化为靶向多个受体(GLP-1、葡萄糖依赖性促胰岛素多肽、胰高血糖素或肽YY)的单分子肽的应用提供可能。
因此,针对GLP-1及其他靶点的双重或三重单分子肽激动剂也或将成为未来的研究热点。
▪ 应用存在局限的创新疗法 基于当前证据,过氧化物酶体增殖物激活受体(PPARs)激动剂、胰高血糖素受体激动剂、葡萄糖激酶激活剂、糖皮质激素代谢酶11β-羟基类固醇脱氢酶(11β-HSD)抑制剂等由于获益风险证据不容乐观,因此不太可能最终应用于临床。
T2DM个体化治疗前瞻文章提出,未来T2DM患者对于降糖药物的选择可能将取决于其具体表型(如根据人体测量指标或实验室参数)甚至是基因型特征。
聚类分析(cluster analysis)结果表明,相同亚组的T2DM人群不仅对特定糖尿病并发症的易感性表现出不同,这部分人群的疾病进展情况也不尽相同。
这表明,同一亚组患者之间发病的主要病理生理学机制可能有所不同,因此最佳治疗策略可能也需有所不同。
未来,基于T2DM患者的遗传特征或可预测特定降糖药物的治疗效果以及不良事件的发生。
小结目前,科学家们正在尝试通过多种创新机制途径为糖尿病患者提供更好的血糖控制疗法,其中部分在研疗法很有可能最终成功并改变T2DM的治疗和管理现状。
论文作者团队指出,智能胰岛素给药制剂、针对线粒体功能受损的药物(如imeglimin)、GLP-1促泌剂、小分子口服GLP-1受体激动剂以及可以同时与多种内分泌激素受体相互作用的单分子肽,有望为改善T2DM患者血糖和体重控制水平提供极大助力。
此外,除了控糖以外,改善T2DM相关的危险因素和合并症的疗法可能会越来越重要。
相关阅读四大组织联合声明:2型糖尿病可以实现“缓解”停药!
“缓解”对患者意味着什么?
ADA糖尿病诊疗标准更新:纳入1型预防疗法、多款药物改善心肾健康柳叶刀、NEJM齐发表!
2型糖尿病治疗或迎“新时代”,双重机制新药降糖、减重效果亮眼《柳叶刀》:司美格鲁肽带来2型糖尿病体重管理突破,全面改善健康让糖尿病患者告别每天注射!

来源:医学新视点
原文链接:http://mp.weixin.qq.com/s?__biz=MzAxOTU2OTU4MQ==&mid=2649932311&idx=1&sn=eb6e15a43296fbc478644a62a309a032
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
CACA指南认证专家――内分泌保护
剂量越小,毒性越大?这是种不按常理出牌的化合物




【学术】将血糖稳定在适宜范围将改善COVID-19合并T2DM患者的临床结局
顾臻团队发明血糖响应智能胰岛素/胰高血糖素复合贴片
内分泌腺
CACA指南认证专家――内分泌保护

抗击疫情 我们在行动 | 中华医学会内分泌学分会开展内分泌患者 免费远程医疗义诊

Nat Biomed Eng : 顾臻团队研发新型“智能胰岛素贴片”

立足病证结合,引领内分泌疾病中医治疗——《内分泌疾病病证结合诊疗指南》启动

【因素】多吃点儿“锰”,可以降低T2DM风险耶!