科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-05
来源:BioArt
肿瘤微环境是一个多细胞组分的微生态系统。肿瘤的发生不单单是肿瘤细胞的改变,肿瘤与微环境中基质细胞的相互作用也起着举足轻重的作用。实体瘤肿瘤微环境中不但包含大量的胞外基质,同样也有包含纤维细胞、肌纤维细胞、脂肪细胞、血管内皮细胞和免疫细胞。不同种类的细胞分别在肿瘤发生的各个阶段中与肿瘤细胞相互作用,并共同促进肿瘤这个微生态系统的发生发展。
脂肪细胞是乳腺基质细胞的重要组成成分。此前的基础研究发现脂肪细胞与肿瘤细胞之间在细胞代谢上存在一种互惠的相互适应关系。与此相应的,临床研究还表明,随着世界范围内肥胖症的增加,几种癌症的患病风险也随之增加。现在的主流观点是脂肪细胞和肿瘤细胞通过生化因子和旁分泌相互作用,进而改变肿瘤微环境中的代谢稳态,最终促进肿瘤的发展。
然而肿瘤的发生并不仅仅带来生化微环境的改变,快速发展的肿瘤同样会改变肿瘤的物理微环境,包括机械挤压周边组织、增加胞外基质的硬度、增加组织渗透压和静水压。尽管人们已经发现肿瘤和周边脂肪细胞通过生物因子和旁分泌相互作用,肿瘤所产生的物理压力是否能影响肿瘤周边基质细胞的命运,肿瘤是否通过物理和力学的方式与周边细胞相互作用还并不清楚。
2019年1月22日,麻省理工学院郭明(Guo, Ming)课题组在Science Advances上发表Compression-induced dedifferentiation of adipocytes promotes tumor progression,报道了几种不同类型的物理压力均可以体外诱导脂肪细胞去分化,去分化的脂肪细胞有能力长期自我复制,并且具有一定的多能干性。物理诱导的去分化脂肪细胞(CiDAs, Compression-induced dedifferentiated adipocytes)在特定的化学因子诱导下可以再次分化成为脂肪细胞、骨细胞、肌肉细胞和软骨细胞,异种移植实验则证明了CiDAs细胞不会形成畸胎瘤。更进一步地,作者发现在体外模型和小鼠异种移植模型中,CiDAs细胞在肿瘤微环境中通过进一步的肌纤维生成,反馈促进了肿瘤和肿瘤细胞的生长和迁移。

本文的研究人员用高渗培养液模拟肿瘤细胞微环境中升高的渗透压,高渗透压条件下培养的人源和鼠源的脂肪细胞会在10天内逐渐失去其标志性脂肪颗粒,并且圆形的脂肪细胞逐渐开始伸展,迁移,最终失去所有的细胞内脂肪颗粒。物理诱导的去分化脂肪细胞(CiDAs)相对于脂肪细胞,重新获得了迁移能力和分裂能力。通过形态学观测,CiDAs细胞更类似于间充质干细胞,其表现为较大的长宽比和更多的细胞分支。为了更近一步的验证脂肪细胞去分化真实发生了,研究人员将脂肪细胞分散在多孔孔板中以确保单个微孔中只有单个脂肪细胞,在高渗培养液的培养下,不但有更多的单个脂肪细胞失去脂肪颗粒,也有更多的单脂肪细胞形成细胞集落。研究人员同样模拟肿瘤微环境,对脂肪细胞施加力学挤压,增加基底材料硬度,同样可以诱导脂肪细胞去分化的发生。在此基础之上,通过测序,免疫荧光,蛋白印记,定量核算扩增等方法发现了Wnt/beta-catenin信号通路在挤压下的高度激活。通过药物抑制Wnt配体的分泌,可以有效的减少物理诱导的脂肪细胞去分化。
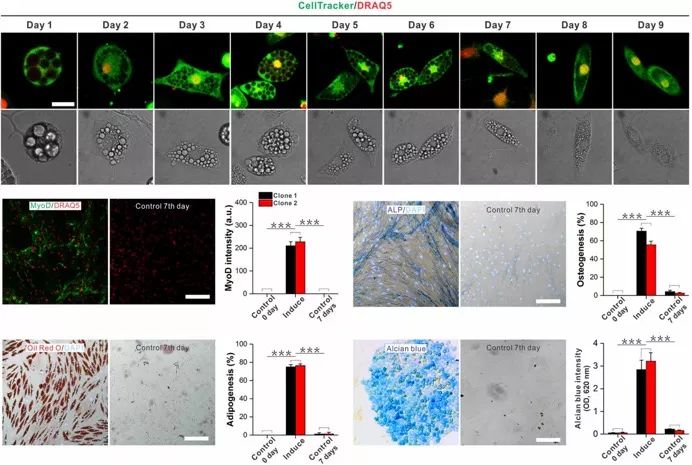
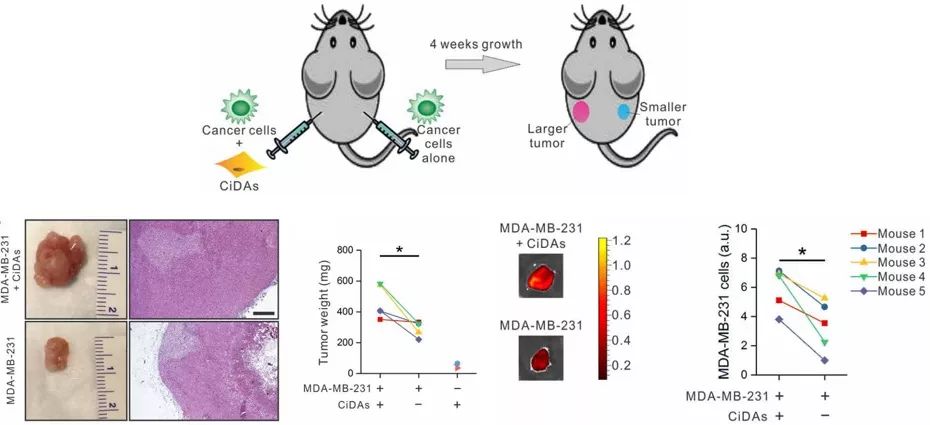
研究人员更进一步地利用裸鼠小鼠模型,发现了CiDAs细胞共培养的肿瘤模型生长速度远大于肿瘤细胞单独培养的肿瘤模型。而单独注射CiDAs细胞不会在小鼠体内形成任何肿瘤或者畸胎瘤。通过免疫荧光染色,研究人员发现肿瘤中的CiDAs细胞均转化为肌纤维细胞。研究人员认为,肿瘤发生过程中极大的改变了肿瘤微环境中的物理因子,这种改变影响了微环境中不同细胞组分的命运,其中可能就包含脂肪细胞的重编程。重编程的脂肪细胞进一步增加了肿瘤微环境中的异质性,去分化的脂肪细胞在肿瘤微环境下进一步通过肌纤维化反馈促进肿瘤的生长。肿瘤和脂肪细胞间的力学相互作用也许是肿瘤发生过程中重要但被忽视的一个必要因素。
本文第一作者李一伟博士介绍:“我们不但探讨了肿瘤微环境中力学相互作用,并且我们可以向肿瘤学习,发展基于力学作用的脂肪细胞体外重编程,这种重编程方式不需要基因编辑和化学小分子的介入,因此生物安全性更容易获得保障。并且,脂肪体细胞来源广泛,易于获取,重编程方法简单,因此,该力学重编程方法可以广泛使用于生产自体来源的间充质类型多能干细胞。相信其在再生医学领域的应用会非常广泛。”
本文的通讯作者郭明(Guo,Ming)教授也向我们介绍:“我们课题组致力于细胞生物物理和生物力学研究,这篇工作和不久之前Nature Physics(“Cell swelling, softening and invasion in a three-dimensional breast cancer model”)的工作,揭示了细胞力学在肿瘤生物学中的重要作用。”
原文链接:
https://advances.sciencemag.org/content/advances/6/4/eaax5611.full.pdf
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480636&idx=5&sn=27efe1d1f2df373e9e2d79a91da0be59&chksm=84e237c8b395bede92eb459ad86b2bb1f118278b9e986d76c2fca8e0d04d0a4fb1005cfc3c06&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nat Med:液体和组织活检检测胃肠道肿瘤的获得性耐药和肿瘤异质性

纯干货:给肿瘤绘制家谱,单细胞测序在肿瘤异质性和发育研究中的大显神通!

广州健康院在提升CAR-T细胞抗异质性肿瘤活性方面取得新进展
“蛋结构”材料能有效杀伤肿瘤细胞

北京协和医院与中科院北京基因组研究所合作揭示胰腺癌肿瘤-微环境高度异质性细胞特征

青年科学家高大明:理解肿瘤、如何防癌
中国科大揭示肿瘤细胞代谢重编程与周期调控新机制

Cell: 肿瘤内的异质性才是决定肿瘤免疫反应的关键
美揭示脑癌细胞长寿关键秘密

国家纳米中心在肿瘤液体活检方面取得进展