科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-12
来源:BioArt
研究和治疗癌症面临的最大难题之一,就是癌症的异质性。肿瘤内异质性(intratumor heterogeneity)是影响肿瘤组织生存进化的主要机制 【1】。之前的研究已经发现基因组层面异质性(genetic heterogeneity)的重要性,即单个肿瘤内部可能存在多个癌细胞种群,而每个种群的基因组不尽相同。即使在单一遗传背景的癌细胞种群内,癌细胞也可能存在多种不同的细胞表型状态,而这种表型异质性会加剧肿瘤的侵入、转移及抗药性【1,2】。癌细胞可以从一种表型状态转移为另一种表型状态——癌细胞的这种可塑性(plasticity)是癌细胞存活的一个重要特点【3】。癌细胞中遗传异质性是后天获得的,但可塑性或表型异质性(non-genetic heterogeneity)往往是从癌起源细胞继承而来,并通过表观遗传调控等机制来传递【4】。
高级别浆液性卵巢癌(high-grade serous ovarian carcinoma)是致死率最高的妇科恶性肿瘤,这一肿瘤常带有TP53突变和染色体异常。据估计,中国每年约有4百万人患上卵巢癌【5】,其中80%-90%为高级别浆液性卵巢癌。大部分卵巢癌病人在晚期才被诊断出来,且五年存活率只在30%左右。目前大量研究证据表明,大部分浆液性卵巢癌的起源为输卵管上皮细胞,但对输卵管上皮细胞的认知目前仅局限于两种细胞类型——PAX8+分泌细胞和TUBB4+纤毛细胞。在输卵管上皮中是否还有其他细胞亚型呢?这些细胞亚型有怎样的分子特征呢?这些存在于癌症起源组织中的细胞亚型和癌细胞又有怎样的联系呢?这些都是亟待回答的问题。
目前对浆液性卵巢癌的治疗方案创新极其受限,主要原因之一就是缺乏一个稳定的肿瘤分子分型体系。之前Tothill和TCGA的研究已经证明高级别浆液性卵巢癌存在转录组异质性【6,7】。但是,现有的分子分型方法完全依赖于对肿瘤样本整体转录组进行聚类分析,因而会受到CNV影响和非癌细胞污染等因素的极大干扰。并且,现有的肿瘤分型方法和病人预后之间的相关性并不够稳定。如果我们能对浆液型卵巢癌起源——输卵管上皮组织——有更深入的了解,是否能帮助我们建立一个能用来预测病人预后的卵巢癌分型体系呢?
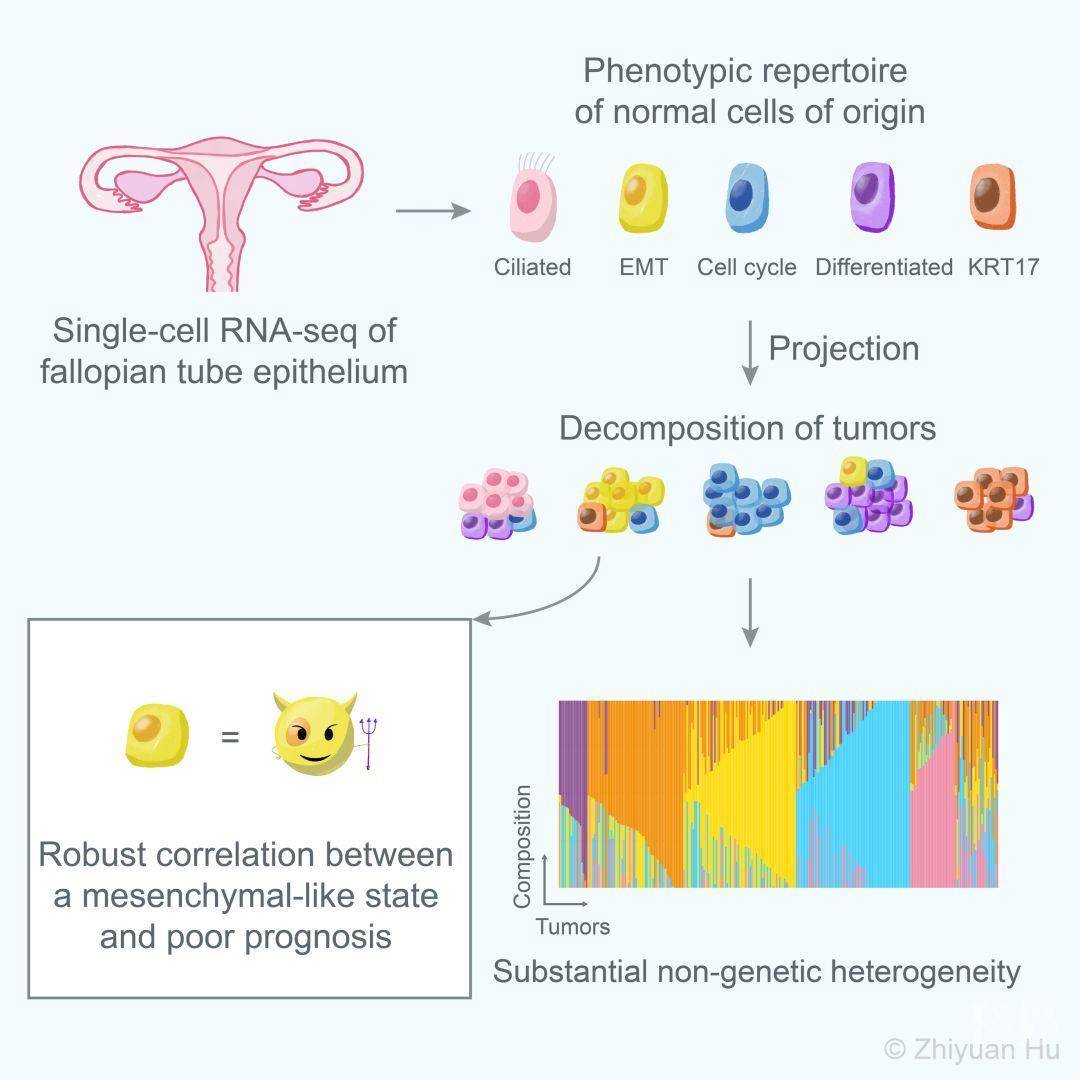
2020年2月10日,牛津大学Weatherall分子医学研究所Ahmed A. Ahmed实验室和曼彻斯特大学Christopher Yau研究组(第一作者为牛津大学Nuffield医学院的博士研究生胡致远)共同在Cancer Cell杂志发表题为The repertoire of serous ovarian cancer non-genetic heterogeneity revealed by single-cell sequencing of normal fallopian tube epithelial cells的研究论文。这项研究首次通过深度单细胞RNA测序技术Smart-Seq2刻画了人输卵管上皮组织,并由此提出了一种与预后稳定相关的分子分型方法。

本研究共测序了约6000个主要来自非卵巢癌病人的正常输卵管上皮细胞(非癌细胞),发现并验证了输卵管上皮内的6种新细胞亚型,包括4种分泌细胞亚型(见原文图2、3),1种分泌-纤毛中间态细胞亚型以及1种特殊的组织原位T细胞(见原文图4)。
对癌细胞可塑性的理解取决于我们能否准确鉴别并刻画单个细胞状态。同时,对癌细胞可塑性的认识可以用于对肿瘤进行分子分型——肿瘤并不一定是由单一表型状态的癌细胞组成,而可能由多种表型状态的癌细胞共存组成。但是,想要直接刻画癌细胞的不同表型并不是一件容易的事,因为非遗传的表型异质性的检测往往会被遗传异质性所干扰。因此,这项研究的研究者们开发了另一种途径:先对癌症细胞起源(cell-of-origin)里的细胞状态进行刻画,再将这些状态投射到癌细胞上,并用各个细胞状态的特征信号对单个肿瘤进行“分解”分析(deconvolution),估算出该肿瘤中每种癌细胞状态的比例。
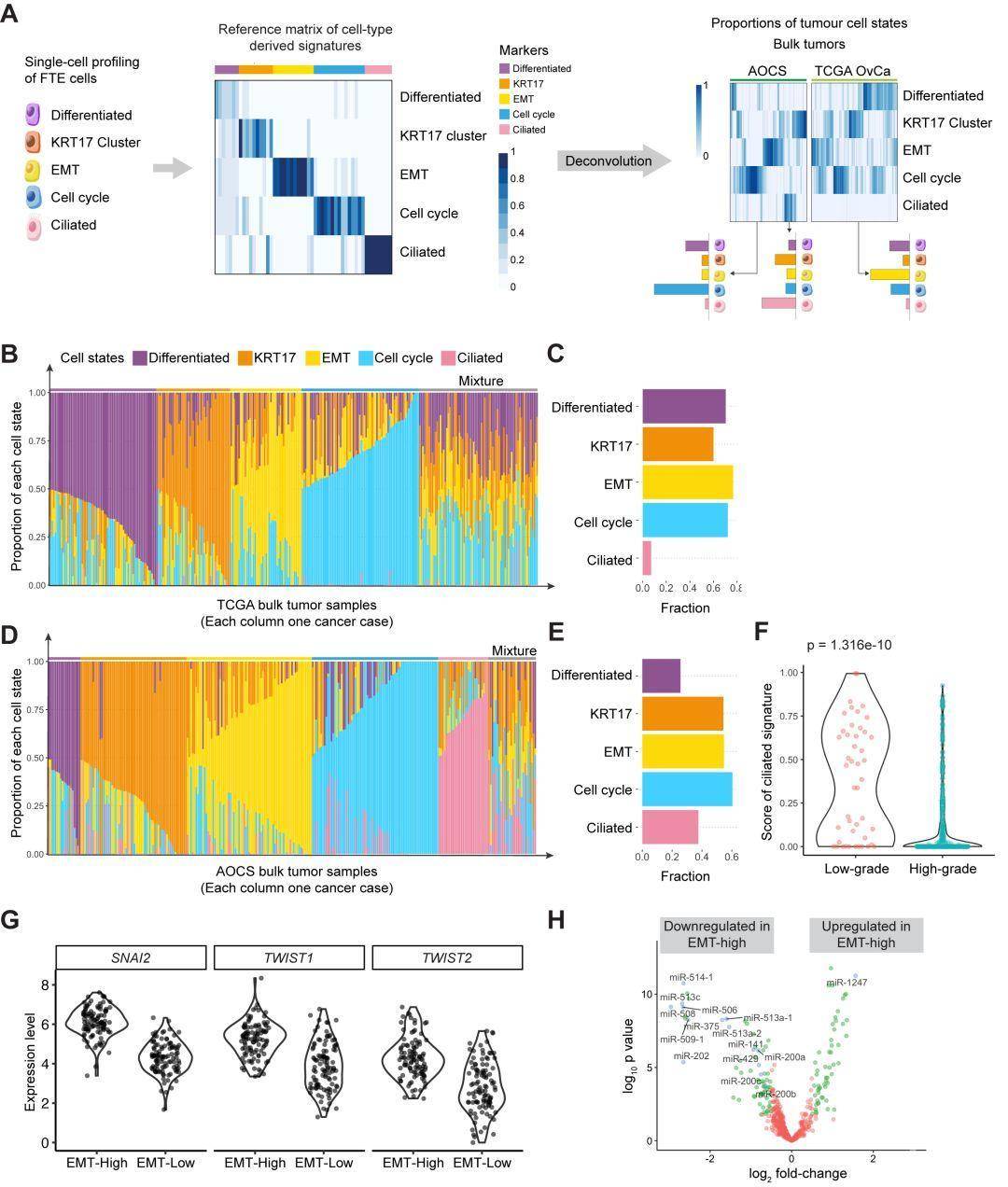
原文Figure 5A,在获得了五种上皮细胞亚型(起源细胞)表达特征谱后,提取出一个由52个标记基因相对表达量组成的参考矩阵,再利用支持向量回归模型对TCGA,AOCS等九个公共数据库中的基因表达数据进行“分解”分析,从而得到每个癌组织里相对应的五种细胞状态各自的比例。
这一“分解”分析重现了肿瘤内异质性。研究者们进一步发现“分解”分析中的EMT(epithelial-mesenchymal transition,上皮-间质转化)细胞状态的比例和病人预后显著负相关,且这一相关性在九个独立数据库中都可被重复出来。对TCGA数据的进一步研究发现,在有大量EMT状态的肿瘤(EMT-high)中,调控EMT的转录因子(SNAI2,TWIST1,TWIST2)发生上调,EMT相关的miRNAs(如miR-200 family)也出现差异性表达。
为了进一步证明EMT及其他四种细胞状态的信号可来自于癌细胞,研究者们利用激光捕获显微切割技术(LCM)获取了纯度更高的肿瘤样本,并进行了转录组测序,对LCM样本数据分析重现了在TCGA等公共数据库里的发现,并通过免疫荧光染色在组织切片和卵巢癌细胞系KURAMOCHI中进行了验证。
总之,这项研究利用单细胞测序刻画了人类输卵管上皮组织(浆液性卵巢癌起源)的细胞图谱,通过利用起源细胞的标记基因组合,定义了一个不良预后的EMT-high亚型。从概念上而言,这项研究表明,通过研究肿瘤的细胞起源,可较为准确地预测癌症发展。在转化意义上,这项研究的成果可对卵巢癌的预后分析带来重要影响,并且为对EMT-high肿瘤亚型的临床治疗方法开发带来启发。
原文链接:
https://doi.org/10.1016/j.ccell.2020.01.003
参考文献
1. Brock, A., Chang, H., and Huang, S. (2009). Non-genetic heterogeneity--a mutation- independent driving force for the somatic evolution of tumours. Nature Reviews Genetics 10, 336–342.
2. Pisco, A.O., Brock, A., Zhou, J., Moor, A., Mojtahedi, M., Jackson, D., and Huang, S. (2013). Non-Darwinian dynamics in therapy-induced cancer drug resistance. Nat Commun 4, 2467.
3. Meacham, C.E., and Morrison, S.J. (2013). Tumour heterogeneity and cancer cell plasticity. Nature 501, 328–337.
4. Gupta, P.B., Fillmore, C.M., Jiang, G., Shapira, S.D., Tao, K., Kuperwasser, C., and Lander, E.S. (2011). Stochastic state transitions give rise to phenotypic equilibrium in populations of cancer cells. Cell 146, 633–644.
5. Jiang, X., Tang, H., and Chen, T. (2008). Epidemiology of gynecologic cancers in China. J Gynecol Oncol. 29 (1): e7.
6. Tothill, R.W., Tinker, A.V., George, J., Brown, R., Fox, S.B., Lade, S., Johnson, D.S., Trivett, M.K., Etemadmoghadam, D., Locandro, B., et al. (2008). Novel molecular subtypes of serous and endometrioid ovarian cancer linked to clinical outcome. Clin. Cancer Res. 14, 5198–5208.
7. Bell, D., Berchuck, A., Birrer, M., Chien, J., Cramer, D.W., Dao, F., Dhir, R., DiSaia, P., Gabra, H., Glenn, P., et al. (2011). Integrated genomic analyses of ovarian carcinoma. Nature 474, 609–615.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480848&idx=5&sn=2a3d8d8b81cdfff1aa7188ae92a485dd&chksm=84e236e4b395bff24a3ce0df7758807cedb1359e45bec6ff1e0e9bcebc05f77c48a90bd3b0b5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究揭示前列腺癌亚克隆演化与肿瘤转录异质性的关联

广州健康院在提升CAR-T细胞抗异质性肿瘤活性方面取得新进展
科学家新发现:癌细胞的另类杀手——合成非免疫细胞
学者发现治疗非小细胞肺癌新方法

Science Advances│王红霞团队研究揭示乳腺癌循环肿瘤细胞异质性

单细胞测序主题月活动第三期|单细胞组学研究肿瘤异质性和转移
新研究发现脂肪细胞为肿瘤供能的机制

科学家发现阻止癌细胞消耗葡萄糖的新方法
Nat Med:液体和组织活检检测胃肠道肿瘤的获得性耐药和肿瘤异质性
通过单细胞测序技术揭示肝胆肿瘤异质性