科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-20
来源:中国生物物理学会
G蛋白偶联受体(GPCR)在细胞信号转导中发挥重要作用,与人类疾病密切相关,是最大的药物靶标蛋白家族,目前40%以上的上市药物以GPCR为靶点。GPCR发挥的生理功能在很大程度上由其所激活的细胞内效应蛋白(G蛋白等)决定。根据其介导的下游信号通路,G蛋白可分为Gs、Gi、Go和Gq等类型,其中,Gs 和Gi被GPCR活化后,分别激活和抑制腺苷酸环化酶,产生相反的生物学效应。研究表明,不同GPCR可选择性激活一种或多种G蛋白,但一种GPCR如何识别不同类型的G蛋白一直未被清晰阐明,制约了对于G蛋白选择调控机制的深入理解。
2017年5月17日,中科院上海药物研究所吴蓓丽、王明伟和蒋华良领衔的科研团队在Nature上发表文章Structure of the Full-Length Glucagon Class B G-protein-coupled Receptor,成功解析“B类”GPCR——人源胰高血糖素受体(GCGR)全长蛋白的三维结构,揭示了该受体蛋白不同结构域对其活化的调控机制(详见BioArt报道:Nature集中发表中国科学家多项GPCR重大成果);2018年1月4日,吴蓓丽与赵强合作在Nature上发表了题为Structure of the glucagon receptor in complex with a glucagon analogue的研究论文,首次测定了胰高血糖素受体GCGR全长蛋白与多肽配体复合物的三维结构,揭示了该受体对细胞信号分子的特异性识别及其活化调控机制。该研究为靶向GCGR的药物设计提供了迄今为止精度最高的结构模版,将在很大程度上促进治疗2型糖尿病的新药的研发(详见BioArt报道:Nature丨中科院上海药物所揭示B型GPCR信号转导机制,该成果有望加速2型糖尿病治疗新药的开发)。这些研究极大地促进了对B类GPCR信号识别和调控机制的认识。
2020年3月20日,吴蓓丽研究组、赵强研究组与中国科学院生物物理研究所孙飞研究组和澳大利亚莫纳什大学Denise Wootten研究组合作在Science上发表文章“Structural basis of Gs and Gi recognition by the human glucagon receptor”,在GPCR结构与功能研究领域取得又一突破性进展:解析了人源胰高血糖素受体(Glucagon receptor,GCGR)分别与激活型G蛋白(Gs)和抑制型G蛋白(Gi)结合的复合物三维结构,这是首次测定一种GPCR与不同类型G蛋白结合的复合物结构,阐明了受体与不同G蛋白的精细结合模式,并揭示了GPCR对G蛋白的选择性机制,为深入认识GPCR的细胞信号转导机理提供了重要的依据。

基于以往的GPCR结构研究,人们普遍认为GPCR通过调节第六跨膜螺旋(TM6)向外迁移的幅度改变其G蛋白结合口袋的大小,实现与不同类型G蛋白的结合。与这一传统认知不同,GCGR-Gs和GCGR-Gi复合物结构显示,GCGR以一个相似的G蛋白结合口袋与这两种功能相反的G蛋白结合。与已经解析的A类GPCR与G蛋白的复合物结构相比,GCGR的G蛋白结合口袋开口更大,不仅可以满足体积较大的Gs蛋白的结合,而且能够容纳体积较小的Gi蛋白,这种利用相似结合口袋识别不同G蛋白的分子机制可大大提高GPCR激活多条下游信号通路的效率。这一发现极大地深化了人们对GPCR信号转导机制的认识。
虽然与Gs和Gi结合时,GCGR形成的G蛋白结合口袋大小相似,但其与两种G蛋白的相互作用模式差异巨大。GCGR与Gs相互作用界面的面积是其与Gi作用界面的两倍,使得该受体与Gs的亲合力高于Gi,这为GCGR主要通过Gs进行信号转导提供了结构基础。此外,研究发现,在这两个复合物结构中,受体分子胞内侧环区(Intracellular loop,ICL)存在较大的构象差异,三个胞内环(ICL1-3)在与不同G蛋白结合时发挥着不同的作用。其中,第二胞内环(ICL2)的构象差异最为显著,该区域与Gs紧密结合;而受体与Gi结合时,ICL2向受体一侧偏移,仅与Gi形成微弱的相互作用。
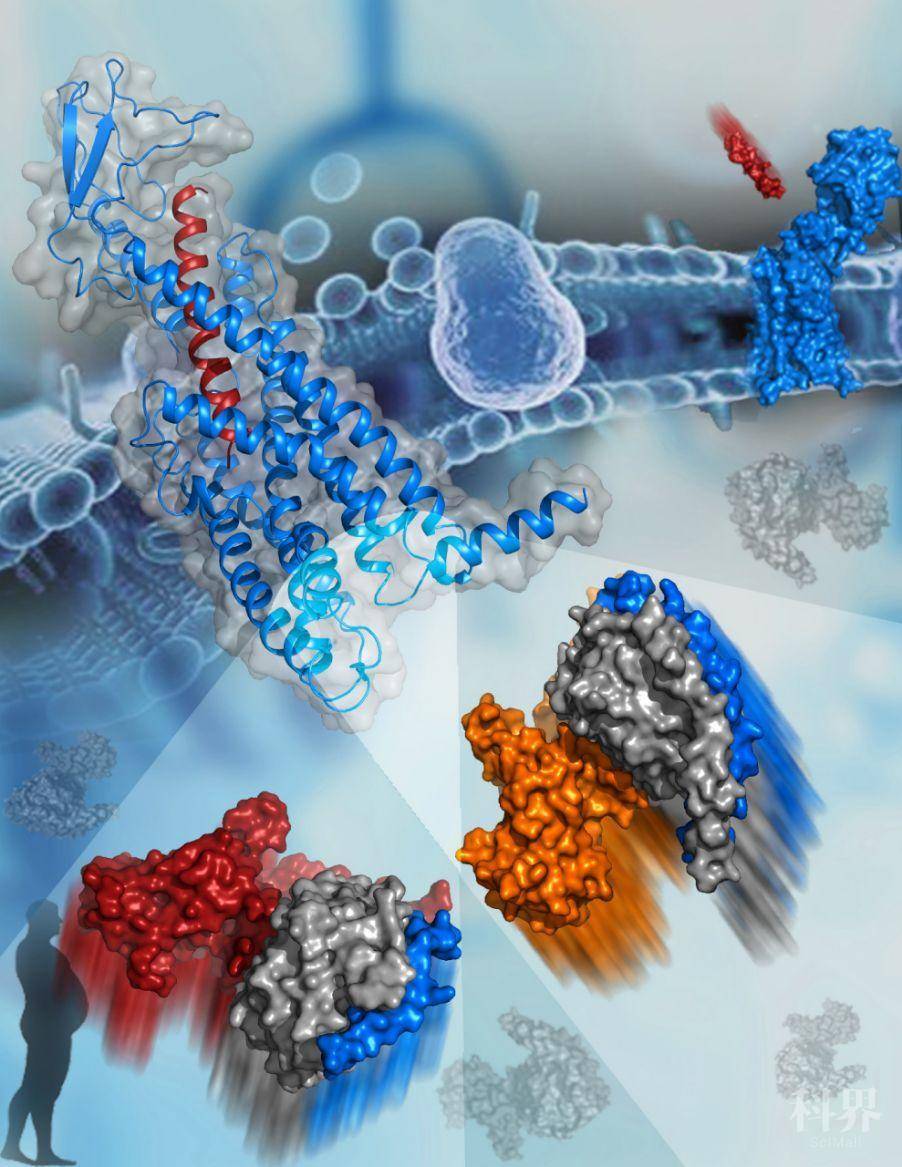
该团队综合利用氨基酸突变、G蛋白激活和细胞信号转导等研究手段,针对GCGR与G蛋白作用界面上的数十个关键氨基酸进行检测,研究它们对Gs和Gi活化的影响。实验结果表明,GCGR的ICL2和第七跨膜螺旋与第八螺旋之间的连接区域对于识别Gs蛋白发挥关键作用,而受体的另外两个胞内环(ICL1和ICL3)和G蛋白结合口袋内的疏水氨基酸则对于结合Gi蛋白至关重要。这是首次在一种GPCR分子中明确不同类型G蛋白的识别关键区域,对于深入研究G蛋白的选择性调控机制意义重大。此外,这些发现为偏向性配体药物的设计提供了重要依据:通过选择性抑制其中一种效应蛋白的活化,有效降低药物副作用,将推动抗2型糖尿病药物的研发。
据悉,研究论文的第一作者是中国科学院上海药物研究所乔安娜博士和韩硕博士、中国科学院生物物理研究所研究生李新美、复旦大学药学院研究生李志鑫和澳大利亚莫纳什大学赵佩珅博士,该项目的主要合作者还包括莫纳什大学Patrick M. Sexton教授、上海药物研究所王明伟研究员、杨德华研究员以及丹麦诺和诺德公司Steffen Reedtz-Runge博士等。
原文链接:
https://science.sciencemag.org/content/367/6484/1346
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649499363&idx=2&sn=9acec0bf8fc1999529caef61d868ad4a&chksm=87d58f68b0a2067ed6cd03aaa523c92ce7e4fbe79d76211c20c34a253be2aee262d50cb2418f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Science:胰高血糖素受体结构揭示G蛋白选择调控机制
血清胰高血糖素(PG)
胰高血糖素或为肾脏健康关键

Science:吴蓓丽/赵强/孙飞等解析胰高血糖素受体结构揭示G蛋白选择调控机制

中国科学家首揭灵长类动物发育和寿命调控的关键通路

人源胰高血糖素样肽-2受体复合物三维结构成功解析

新研究:研制血糖响应智能胰岛素/胰高血糖素复合贴片
人源胰高血糖素样肽-1受体小分子完全激动剂结构与功能研究获进展

吴蓓丽研究组合作发表论文揭示胰高血糖素受体结构揭示G蛋白选择调控机制
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知