科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-09
来源:iNews
北京时间4月8日,由浙江大学、青岛大学、台湾地区中国医药大学以及美国MD安德森癌症中心合作,浙江大学医学转化研究院/浙江大学医学院附属第一医院吕志民教授团队联合台湾地区中国医药大学洪明奇团队在国际顶级杂志《自然》(Nature)上在线发表研究论文,论文题目为《The gluconeogenic enzyme PCK1 phosphorylates INSIG1/2 for lipogenesis》,该论文揭示了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制。
正常细胞脂质转运及代谢通路的科学发现,获得了1985年诺贝尔生理学/医学奖。在正常的细胞中,脂质合成的“工厂”采取高效的“按需生产”原则:即只有细胞感受到脂质浓度不足时,工厂才“开工”;一旦脂质浓度恢复正常,工厂便“停产”。然而,在肿瘤细胞中,脂质合成的“工厂”始终加班加点的“生产”:即使细胞内脂质浓度是正常的,脂质代谢仍处于高度活跃,并促进肿瘤的快速增殖。因此,研究肿瘤细胞有别于正常细胞脂质代谢的分子机制,成为肿瘤研究领域当前的核心问题之一。
为肿瘤治疗找到新的靶标
肿瘤的大量基因突变及特有的微环境,往往导致代谢酶原有的功能改变并赋予其新的非经典功能。继发现糖代谢酶PKM2、PGK1和KHK-A的非代谢酶活性在肿瘤发生中的重要作用之后,该研究是吕志民团队发现的第四个具有蛋白激酶活性的代谢酶。
该研究不仅阐明了肿瘤细胞脂质感应异常及脂质合成持续激活的重要机制,首次发现了糖异生代谢酶PCK1具有蛋白激酶活性,而且揭示了PCK1以GTP作为磷酸基供体对蛋白底物进行磷酸化,这有别于普遍的以ATP作为磷酸基供体的蛋白激酶。同时研究也论述了PCK1的内质网易位是肿瘤细胞协同调节糖异生降低和脂质合成激活的重要分子机制。
吕志民表示,这项研究不仅为癌症的个体化治疗提供了新的代谢标记物和分子靶点,而且对靶向肿瘤脂代谢的药物研发具有重大的指导意义。“这项研究让人类对肿瘤代谢的认知又迈出了一步,我们不仅要观其表,更要明其因,为制造高效低毒的肿瘤药物寻找新出路。”
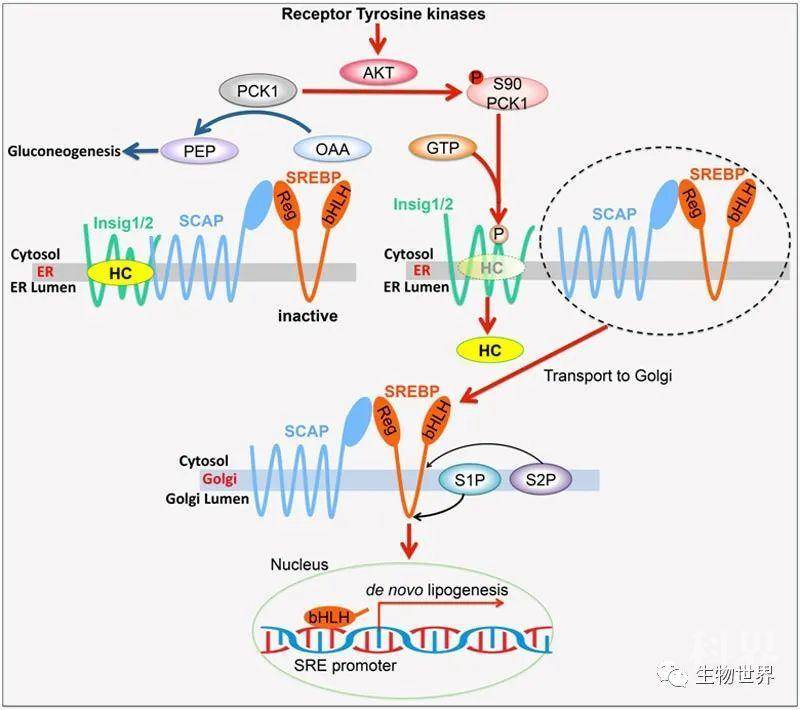
图2:PCK1介导的Insig1/2磷酸化促进脂质合成和肿瘤发生的分子机制
(注:HC:羟基胆固醇;OAA:草酰乙酸;PEP:磷酸烯醇式丙酮酸;bHLH:SREBP的碱性螺旋-环-螺旋结构域;Reg:SREBP的调节亚基;ER:内质网;Golgi:高尔基体。)

吕志民
博士生导师,王宽诚杰出讲席教授
研究领域:肿瘤代谢、肿瘤发生与发展
吕志民教授三个原创性里程碑发现,深刻影响了业界对肿瘤代谢的认识, 同时也对开拓新的肿瘤诊治方法提供了创新理论支持:
1.国际上首次系统性的阐明了生长因子受体促进 Warburg 效应的调控机制
Warburg 效应是近百年前由德国诺贝尔奖获得者 Warburg 发现的肿瘤代谢特征, 即肿瘤细胞即使在有氧条件下依然依赖糖酵解供给能量, 而抑制线粒体能量代谢的现象。Warburg 效应是临床广泛使用的 PET 检查的理论基础, 但其调控机制一直不明确。吕教授发现, 生长因子受体(EGFR, FGFR, PDGFR)的激活可以诱导糖酵解途径中发挥重要作用的丙酮酸激酶M2(PKM2)进入细胞核内,结合并激活 β-catenin (Nature, 2011),磷酸化组蛋白 H3 (Cell,2012;被 Science Signaling 评选为 2012 年信号转导领域的重大突破),从而促进糖酵解相关基因的表达并增强葡萄糖摄取和乳酸产生 (Nature Cell Biology, 2012; Molecular Cell, 2012)。此外,EGFR受体的激活,低氧,或K-RAS G12V和B-Raf V600E的表达可以诱导糖酵解途径中的磷酸甘油酸激酶1(PGK1)转入线粒体,PGK1通过磷酸化并激活丙酮酸脱氢酶激酶 1(PDHK1)来抑制线粒体丙酮酸代谢,从而促进 Warburg 效应 (Molecular Cell, 2016)。吕教授还发现PTEN可以通过去磷酸化和抑制自我磷酸化的PGK来抑制有氧糖酵解,而肿瘤细胞中的PTEN缺失可以诱发Warburg 效应(Molecular Cell,2019)。因此, 吕教授揭示了肿瘤细胞中核转位的PKM2,线粒体转位的PGK1,及PTEN缺失引起的PGK1激活调控Warburg 效应。
2.国际上首次发现多种重要的代谢酶同时具有蛋白激酶活性
发挥蛋白激酶活性的PKM2除了可以磷酸化组蛋白外,还可以通过磷酸化纺锤体组装蛋白 Bub3 以调节细胞分裂中期的染色体分离, 通过磷酸化肌球蛋白轻链 2 以促进胞质分裂 (Molecular Cell, 2014;Nature Communications,2014)。此外,吕教授首次发现肝细胞肝癌会发生果糖激酶(KHK)基因前体mRNA的可变剪接,将KHK基因类型从与果糖高亲和力结合的KHK-C转换为低亲和力的KHK-A。而KHK-A在肝细胞肝癌中可以发挥蛋白激酶活性,一方面通过磷酸化并激活磷酸核糖焦磷酸合成酶 1(PRPS1)以促进核酸的从头合成和肝癌的形成 (Nature Cell Biology, 2016), 另一方面通过磷酸化 p62来激活 Nrf2 依赖的抗氧化反应 (Science Advances, 2019)。PGK1也可以发挥蛋白激酶活性,线粒体内的PGK1可以通过磷酸化并激活PDHK1调控线粒体功能;而在能量缺乏的条件下,PGK1 可以通过磷酸化 Beclin1 调节自噬 (Molecular Cell, 2017)。因此, 吕教授的代谢酶具有蛋白激酶功能的发现为肿瘤诊疗提供了重要靶点。
3.国际上首次证实多种代谢酶在肿瘤细胞活动调控中具有重要的非代谢功能
吕教授发现代谢酶PKM2,PGK1,KHK-A,和PCK1可以调控基因表达、有丝分裂、胞质分裂、核酸的从头合成,自噬和脂肪生成。除此之外,吕教授还发现:(a) 延胡索酸酶可以调节 DNA 修复 (Nature Cell Biology, 2015);(b) 核内的乙酰辅酶 A 合成酶 2 (ACSS2)在启动子区域产生乙酰辅酶 A,并诱导溶酶体合成基因和自噬基因的表达 (Molecular Cell, 2017); (c) α-KGDH 关联的 KAT2A 作为组蛋白 H3 琥珀酰转移酶可以调节基因表达 (Nature, 2017); (d)核内的PGK1通过减轻ADP对CDC7的抑制来促进DNA的复制 (Molecular Cell, 2018);(e)EGFR磷酸化后的血小板型的磷酸果糖激酶(PFKP)可以激活肿瘤细胞中的PI3K通路 (Molecular Cell, 2018)。因此,吕教授的研究成果改变了业界对肿瘤代谢的传统认知。
教育背景:
1998 美国纽约市立大学 分子、细胞及发育生物学专业 博士
1986 泰山医学院 临床医学专业 学士
研究工作经历:
2019—至今 浙江大学王宽诚杰出讲席教授
2015—2018 美国德克萨斯大学安德森癌症中心,肿瘤代谢中心,主任
2015—2018 美国德克萨斯大学安德森癌症中心,Ruby E. Rutherford杰出冠名教授
2013—2018 德克萨斯大学安德森癌症中心神经肿瘤学 教授(终身教职)
2009—2013 德克萨斯大学安德森癌症中心神经肿瘤学 副教授(终身教职)
2003—2009 德克萨斯大学安德森癌症中心神经肿瘤学 助理教授
1999—2003 SALK生物学研究所分子细胞肿瘤学 研究助理/博士后
1993—1999 纽约市立大学研究生院分子细胞肿瘤学 研究助理
荣誉及奖项:
2019 浙江大学王宽诚杰出讲席教授
2017 美国科学促进会(American Association for the Advancement of Science )会士
2016 美国德克萨斯大学MD安德森癌症中心Dallas/Fort Worth传奇人物基础研究成就奖
2015 美国德克萨斯大学科学技术获得和保留(STARs)奖
2015 美国德克萨斯大学MD安德森癌症中心Ruby E. Rutherford杰出教授
2013 中国教育部“长江学者”讲座教授
2013 美国德克萨斯大学MD安德森癌症中心Potu N. Rao基础科学卓越奖
2012 美国James S. McDonnell基金会学者奖
2011 美国德克萨斯大学MD安德森癌症中心Faculty学者奖
2009 美国癌症协会研究学者奖
2008 美国Peter Steck青年研究者奖
2005 中国科学院王宽诚基金会奖
2000 美国加州乳腺癌研究计划博士后奖学金
1999 美国Salk先锋基金奖学金
1997 美国纽约城市大学亨特学院生命科学 Beatrice Goldstein Konheim 研究生奖学金
来源:MedicineWorld iNews
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyMjY5MDAwMA==&mid=2247485584&idx=1&sn=1f872ccca2f731359ebf94c4b3ddc06b&chksm=e828e72fdf5f6e39ce4cdee8e221b1164b319033e64294cbc18baba257a5b33d489fa0691a67#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
上海药物所发现仿生纳米笼可特异性靶向肿瘤干细胞抗肿瘤转移----中国科学院
理化所等在特异性诱导肿瘤细胞焦亡纳米药物研究中获进展

磷酸化修饰组学揭示KRAS突变肿瘤的精准治疗新策略
中国抗癌协会肿瘤护理专业委员会在津成立




于云层和浪花中诞生,生命的起源充满了温柔的诗意
Adv. Mater.:人造自然杀伤细胞用于肿瘤特异性抑制和叛变巨噬细胞的再教育

辽宁省细胞生物学学会分子诊断专业委员会胸部肿瘤基层MDT学组成立大会暨辽沈胸部肿瘤多学科论坛在沈阳 召开

滴血检测肿瘤将成为可能!特异性达到90%以上
光合磷酸化作用

肿瘤引流淋巴结抗原特异性记忆CD8T细胞的研究