科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-22
来源:X一MOL资讯
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657633107&idx=5&sn=7b526787da5f9e5e0af0f046471daa3d&chksm=80f86a83b78fe3957f2d664c7fed1db2dae17ad8cce23430f87da2605b4027fc2bd38a8c5d58&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

心血管疾病治疗:让乙酰化提供“活靶子”

孩子胃口不好不长肉,真的缺赖氨酸吗?
叔丁氧羰基-赖氨酸-ε-15N

葛均波院士Nature子刊:谈心血管疾病治疗靶点
Nature:酵母"吃"得好,还可以抵御危害过程




赖氨酸水平可引起瘤胃微生物代谢途径变化
赖氨酸检查

过程工程所开发聚赖氨酸分离纯化生产新工艺
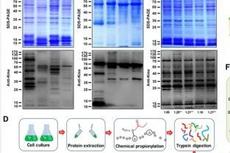
蓝细菌赖氨酸单甲基化修饰研究获进展
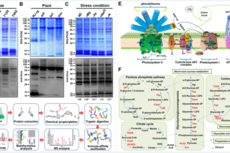
水生所蓝细菌赖氨酸单甲基化修饰研究获进展