被Nature Methods杂志选为2013年年度技术的单细胞测序技术,从诞生之日起就格外引人瞩目。与普通测序不同,单细胞测序规避了细胞异质性带来问题,科学家们可以通过该技术表征单个细胞的基因组概况(例如基因组、转录组、甲基化组、染色质结构等),从而对生物组织中的细胞进行分型。除此之外,更重要的是对每种细胞类型的基因调控网络、潜在的染色质结构和关键转录因子(Transcription Factor,TF )的探测,这可理论上以由单细胞RNA-seq联合单细胞ATAC-seq(Assay for Transposase-Accessible Chromatin with high throughput sequencing)来实现。然而,尽管单细胞RNA-seq技术人们已经获得了包括人类在内的不同生物的细胞图谱(Nature | 郭国骥团队报道首个人类细胞图谱)【1,2】,但由于单细胞RNA-seq的RNA检测能力较低,限制了单个细胞中能够检测到的基因数量,现有方法几乎无法提供有关基因-基因相互作用和调控网络的信息【3】。单细胞ATAC-seq也已广泛用于细胞分型,科学家创建了果蝇和小鼠等整个生物体的顺式调控图谱【4,5】。但是,单细胞ATAC-seq的检测能力同样有限,会导致假阴性结果的出现【6,7】。因此,高精度的单细胞测序技术亟待开发和整合。
近日,来自北京大学生物医学前沿创新中心的谢晓亮教授、高歌教授、汤富酬教授以及北京大学第三医院生殖医学中心乔杰院士强强联合共同发布了预印本文章Genomic Architecture of Cells in Tissues (GeACT): Study of Human Mid-gestation Fetus,描绘了人类中期妊娠(19-21周)胎儿组织细胞的基因组架构(Genomic Architecture of Cells in Tissues,GeACT)。该项研究中,在两种新开发的单细胞技术(MALBAC-DT和METATAC)的加持下,研究者分析了人类中期妊娠(19-21周)胎儿消化、免疫、循环、呼吸、生殖和泌尿系统中多个代表器官和组织的转录组和染色质可及性。将基因表达谱与潜在的染色质状态联系起来,研究者发现了具有代表性的相关基因模块 (Corrected Gene Modules,CGMs) 的关键转录因子,从而加深了我们对于胎儿发育的理解。 文中用到的MALBAC-DT法【3】(见本文method部分)提高了RNA-seq中对RNA的检测能力,不仅可以检测到更多的基因,还可以检测所有表达基因的协方差矩阵,从而产生相关CGM,即共同执行某些生物学功能的相互关联的基因簇。此外,这项工作中研究者使用了一种名为METATAC(高精度单细胞ATAC-seq)的新方法来生成不同人体组织的染色质可及性图(见本文method 部分),与以前的方法相比,该方法显示出可接近的染色质区域的独特DNA片段增加了约100倍【4】。同时拥有CGM和基因组架构,研究人员就可以描绘出与CGM相关的关键TF。
文中用到的MALBAC-DT法【3】(见本文method部分)提高了RNA-seq中对RNA的检测能力,不仅可以检测到更多的基因,还可以检测所有表达基因的协方差矩阵,从而产生相关CGM,即共同执行某些生物学功能的相互关联的基因簇。此外,这项工作中研究者使用了一种名为METATAC(高精度单细胞ATAC-seq)的新方法来生成不同人体组织的染色质可及性图(见本文method 部分),与以前的方法相比,该方法显示出可接近的染色质区域的独特DNA片段增加了约100倍【4】。同时拥有CGM和基因组架构,研究人员就可以描绘出与CGM相关的关键TF。
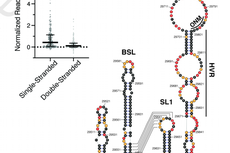
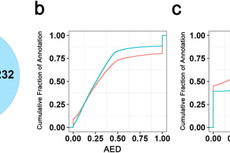
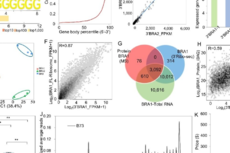
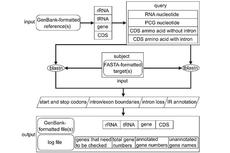
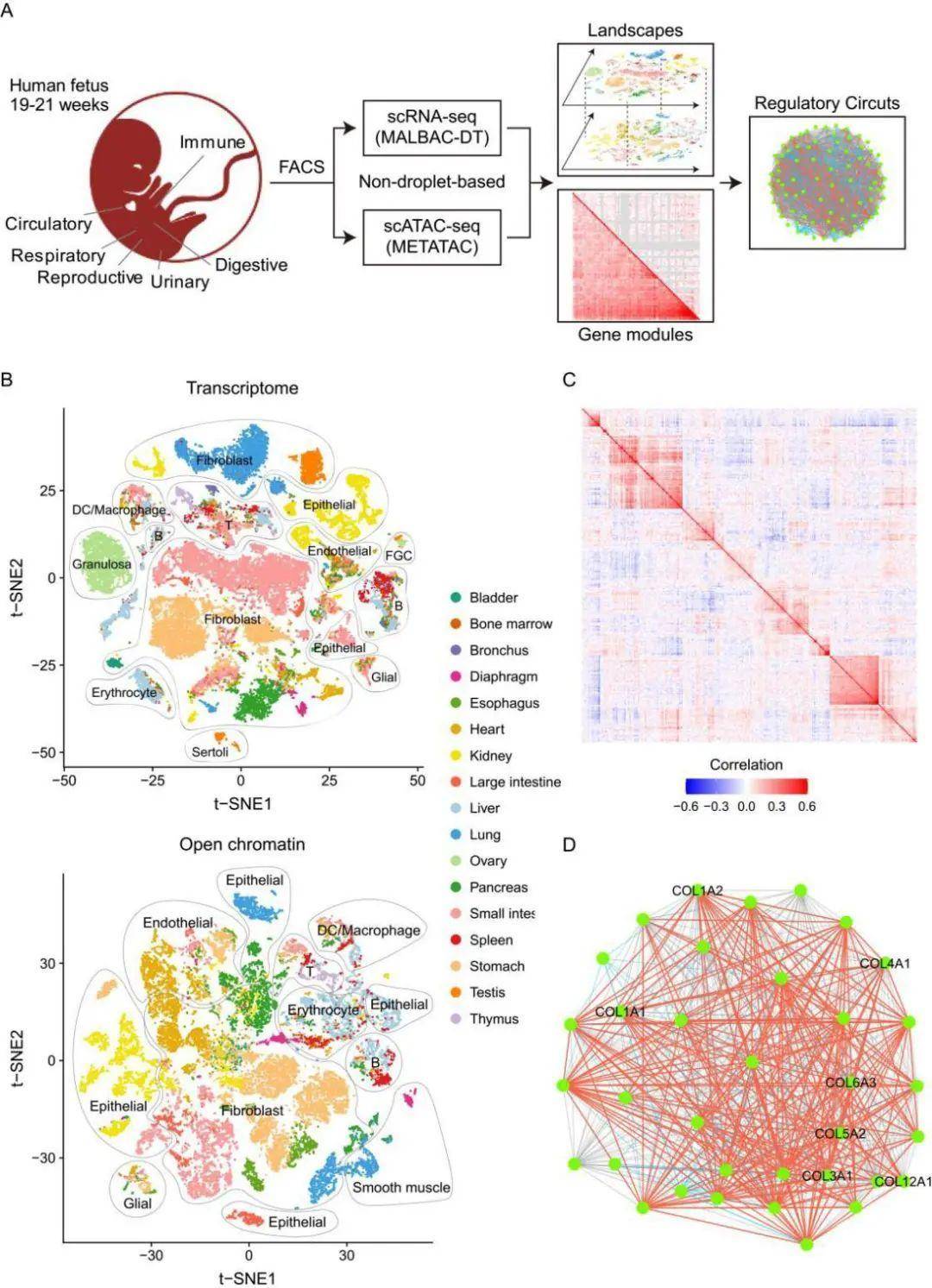 图1. 单细胞数据生产和分析的工作流程
图1. 单细胞数据生产和分析的工作流程
研究人员收集了胎儿在妊娠后19-21周的17个代表性器官(食道、胃、小肠、大肠、肝脏、胰腺、肾脏、膀胱、支气管、肺、骨髓、脾脏、胸腺、有动脉的心脏、隔膜、卵巢和睾丸),包含了31个不同采样位置(例如胃底、胃体和胃窦)。基于非标记的FACS分选后,研究人员采用了高精度单细胞RNA-seq方法(MALBAC-DT)【3】进行文库制备和cDNA测序,从而产生了转录组图谱。为了探索每个器官的细胞组成,研究人员处理了单细胞数据并获得了228个细胞簇,每个簇都根据文献中的著名标记基因进行了注释,然后将所有细胞聚集在一起以构成全局转录组图谱。该图谱中包含了大多数器官中常见的6种细胞簇(上皮细胞、内皮细胞、成纤维细胞、神经胶质细胞、免疫细胞和红细胞)以及性器官特有的几个细胞簇,例如卵巢中的Granulosa细胞和睾丸中的支持细胞。研究人员对比了这些细胞在组内以及发育过程中的异同,发现了很多有趣的现象。
来自不同器官但具有相似生理特性的细胞类型(例如上皮细胞、内皮细胞和成纤维细胞)往往会被归类在一起,表明它们在不同器官中的功能和基因表达模式相似,但是生理特性相似的细胞在不同器官中也会表现出不同的特征。
为了进一步探索细胞类型特异性基因表达谱背后的表观遗传机制,研究人员从相应胎儿的14个代表性器官(卵巢,睾丸,支气管除外)中分离了细胞核。解离后,使用高精度单细胞ATAC-seq方法(METATAC)进行文库制备,然后进行深度测序。根据该结果对细胞类型进行注释,研究人员获得177个细胞簇。这些结果与转录组高度一致,证实了利用METATAC来进行细胞分型是可靠的。并且,这些结果也证明了染色质可及性可以真实地反映转录因子的活性。基于全面的染色质可及性信息,研究者将非免疫细胞聚类在一起,得到了与转录组数据类似的结果,即来自不同器官的类似表观基因组的细胞倾向于聚类在一起。有趣的是,与RNA表达谱数据不同,来自肾脏、大肠、肺和胃的红细胞聚类在同一器官的其他细胞类型中,而不是聚类在其他器官的红细胞中,这表明,临近细胞存在某些潜在的相互作用。
基于MALBAC-DT和METATAC的数据,研究人员描述了跨细胞类型的CGM。他们选择分析细胞数量最多的10种细胞类型用于CGM检测,获得了227个非冗余CGM。超过60%的CGM显示出TF的富集,这反映了TF对共表达基因调控的贡献。在一半的CGM中观察到了丰富的蛋白质-蛋白质相互作用(PPI),这表明关联转录是蛋白质活性同步的关键过程。尽管蛋白质编码基因占CGM的大部分(超过90%),但每个CGM中都有大量非编码基因。出乎意料的是,对于大多数CGM,基因分散在不同的染色体上,这表明相关基因仅通过基因组邻近性连接(即顺式效应)。相反,具有较高相关性的CGM更可能包含常见的上游TF调节因子,这表明反式作用是相关基因的主要驱动力。此外,高相关性CGM倾向于包含丰富的PPI,GO生物学过程和KEGG通路,这进一步突显了基因功能的协同作用。CGM在不同细胞类型中可能显示出不同的共表达水平。此外,研究人员验证了如果基因在一种细胞类型中高度共表达,那么这些基因的调控基因组元件的表观遗传状态应在这种细胞类型中同步变化。这些结果还表明,基因调节区的共可及性是一对基因共表达的必要但不充足的条件。在多种细胞类型中普遍存在的CGM通常参与比较基本的生物过程,例如代谢、蛋白质折叠和翻译。
总之,该项研究首次利用两项新的单细胞技术MALBAC-DT和METATAC,得到了基于横跨多个胎儿器官的无偏见,高精度组学数据——识别了所有六个主要系统中的200多种不同类型的细胞,并得到了胎儿发育过程中细胞类型内的相关基因模块(CGM)概况,由此极大地拓展了人们对于胚胎发育过程的认知。在拓宽人类功能基因组的理解上,GeACT还将大有可为。
参考文献
1. Cao, J., et al., The single-cell transcriptional landscape of mammalian organogenesis. 2019. 566(7745): p. 496-502.2. Han, X., et al., Mapping the mouse cell atlas by microwell-seq. 2018. 172(5): p. 1091-1107. e17.3. Chapman, A.R., et al., Correlated Gene Modules Uncovered by Single-Cell Transcriptomics with High Detectability and Accuracy. 2020: p. 2019.12. 31.892190.4. Cusanovich, D.A., et al., A single-cell atlas of in vivo mammalian chromatin accessibility. 2018. 174(5): p. 1309-1324. e18.5. Cusanovich, D.A., et al., The cis-regulatory dynamics of embryonic development at single-cell resolution. 2018. 555(7697): p. 538-542.6. Buenrostro, J.D., et al., Integrated single-cell analysis maps the continuous regulatory landscape of human hematopoietic differentiation. 2018. 173(6): p. 1535-1548. e16.7. Preissl, S., et al., Single-nucleus analysis of accessible chromatin in developing mouse forebrain reveals cell-type-specific transcriptional regulation. 2018. 21(3): p. 432-439.来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483755&idx=1&sn=1229b1f4421c6be0b9b5558575de4098&chksm=84e2231fb395aa09f3b147a3558a5e3169903b6455187a6bb830f29de598828d007f143501d6#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

 图1. 单细胞数据生产和分析的工作流程
图1. 单细胞数据生产和分析的工作流程