科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-03
来源:BioArt
撰文 | 章台柳
基因工程编辑的免疫细胞疗法已经被证实对某些癌症有效,但对大多数肿瘤效果甚微。抗原特异性的人T细胞能够通过将特定的TCRs、嵌合抗原受体(CARs)或其他合成受体经非靶向病毒转导而在体外生成。可编程核酸酶如CRISPR-Cas9联合病毒或非病毒转导能将抗原受体基因定向整合到特定基因组位点,而近期研究揭示了定点整合的潜在优势【1】。CAR T细胞被批准用于治疗某些恶性血液肿瘤,但尚未证明对实体瘤有效。设计T细胞的抗原特异性时,不仅需要其能够靶向肿瘤,而且需要T细胞在免疫抑制性肿瘤微环境中保持其抗肿瘤的功能。例如,肿瘤可与TGF-β等抑制性细胞因子共同抑制T细胞功能;肿瘤中Tregs、MDSCs、DCs、基质细胞等可夺取T细胞必需的共刺激信号或诱导抑制信号;实体瘤中过多的抗原密度和抗原暴露动力学导致T细胞衰竭或功能失调。所以,下一代的细胞免疫可能需要通过增强功能的基因编辑来克服实体肿瘤微环境的挑战【2】。缺失抑制性检查点通路如PD-1和CTLA4是增强免疫细胞疗法的一种策略,然而敲入基因重新编程细胞的应用潜能更大。小鼠模型中对T细胞信号和功能的研究提出许多可能增强细胞治疗的候选基因产物。然而,到目前为止,缺乏快速的方法来检测和直接比较人类原代细胞中大片段DNA敲入整合的功能,而这将加速细胞免疫治疗的发展。
近日,来自加州大学旧金山分校的Alexander Marson在Cell杂志上发表文章Pooled Knockin Targeting for Genome Engineering of Cellular Immunotherapies,利用DNA条形码和测序技术对大片段非病毒DNA模版在基因组特定位点的靶向整合进行追踪,开发出可应用于人原代T细胞的混合敲入筛选技术,并利用该技术能够揭示出增强T细胞在体内外适应性的基因结构。将单细胞转录组测序和混合敲入筛选技术进行整合开发出混合敲入测序技术PoKI-seq,实现同时测量敲入基因结构的细胞丰度和细胞在体内外的状态。利用PoKI-seq平台揭示出TGF-βR2-4-1BB嵌合TCR受体显著提高实体瘤的清除率。

研究人员希望开发一个适应性平台,可将多个DNA条形码标记的模版引入特定的基因组靶点,通过表型筛选或单细胞转录组分析来评估其对人T细胞在体内外行为的影响。即首先构建一个假定能增强T细胞治疗的HDR模版库,每个HDR模版包含固定的TCR-α和TCR-β(研究使用NY-ESO-1抗原特异性TCR,克隆1G4)以及一个独特的第三基因结构。同时开发一种深度测序策略,选择性捕获on-target敲入的DNA序列,配合TCR-α中插入的DNA条形码,使用PCR反应能测量目标插入基因结构在每个细胞中的丰度。利用非病毒转导的方式敲入DNA条形码标记的GFP和RFP,检测发现只有25%的细胞显示出多重整合的迹象;构建文库时混合时机不同,模版切换比例各异,综合后选定在电穿孔阶段将敲入质粒进行混合,即只有10%的细胞显示出模版转换的迹象。多重整合和模版切换都能影响混合筛选的准确性,而上述结果显示DNA条形码测序能够在混合的敲入实验中定量地追踪编辑细胞的表型。随后,研究人员构建了36个混合模版的文库进行测试,发现所有敲入结构能在四个独立的人捐赠T细胞群中表达,即使是2kb-3kb的较大片段。而且,测序得到的GFP和RFP DNA条形码比例基本与蛋白水平上GFP+和RFP+细胞比例类似。用IL-2培养基因结构敲入的T细胞群,并追踪随着时间的推移DNA条形码的相对缺失,发现只有敲入IL-2RA的条形码随时间富集,这与IL-2RA促进T细胞适应性相一致。这表明该方法可以在人T细胞群体中产生大量的混合敲入文库,并对其DNA条形码进行定量测定。
为了研究哪些基因结构可以增强T细胞在不同选择压力下的细胞适应性,研究人员选取了36个基因结构进行文库构建,包括已发表的和新型显性负性受体、具有编辑过细胞内结构域的合成类“开关”受体、异源转录因子、代谢调节因子、能改变细胞对抑制性或凋亡信号反应的合成敲除结构、能与细胞适应性和活化相关的基因等,混合后靶向整合到TRAC位点。为了检测插入的基因结构是否能增强体外刺激下T细胞的扩增,研究人员使用anti-CD3/CD28刺激细胞,发现多种合成性Fas受体显著富集,表明促进细胞适应性;同时,截短型CTLA4蛋白表达则由于竞争CD28共刺激信号而降低细胞适应性。模拟肿瘤微环境给予T细胞刺激,发现TCF7在过度刺激信号下略微增加细胞适应性,TGF-βR受体(包括已经报道的截短型TGF-βR2和新型TGF-βR2-4-1BB)促进T细胞对抑制性细胞因子TGF-β1刺激的适应性。此外,研究人员进一步验证了筛选出的候选基因结构可在单个敲入实验中提升T细胞适应性。结果显示,这些候选基因结构不仅能在蛋白水平表达,促进T细胞扩增,而且能增强T细胞对肿瘤细胞的体外杀伤作用。例如TGF-βR2-4-1BB能增强T细胞的杀伤功能,无论是否存在外源性TGF-β。
研究人员将混合敲入筛选与scRNA-seq相结合,记录修饰细胞状态的转录组信息,同时记录每个细胞的特定敲入条形码信息,称为混合敲入测序(PoKI-seq)。即在单细胞液滴分离转化为cDNA的mRNA文库,一部分用于scRNA-seq测序,一部分用于敲入条形码的靶向扩增测序。研究人员利用PoKI-seq对体外培养的、离体的、小鼠实体瘤内的人T细胞进行测序,充分探讨并验证了PoKI-seq对敲入结构和细胞状态信息记录的准确性,并且揭示出基因结构的敲入不仅影响T细胞的适应性,而且对细胞状态有调控。最后,研究人员使用实体瘤模型对筛选出的TCF7和TGF-βR2-4-1BB的功能进行验证。虽然两者都能增加TIL的数量,但TCF7增加CCR7+ TIL亚群的数量,T细胞状态更偏向于naïve或休眠态,而TGF-βR2-4-1BB则增加IL-2+和IFNG+ TIL亚群,T细胞状态偏向于激活态,表达关键性效应细胞因子。与TCR对照相比,TCF7-TCR对肿瘤生长没有影响,而TGF-βR2-4-1BB-TCR则显著减少肿瘤大小,且部分实体瘤完全清除。
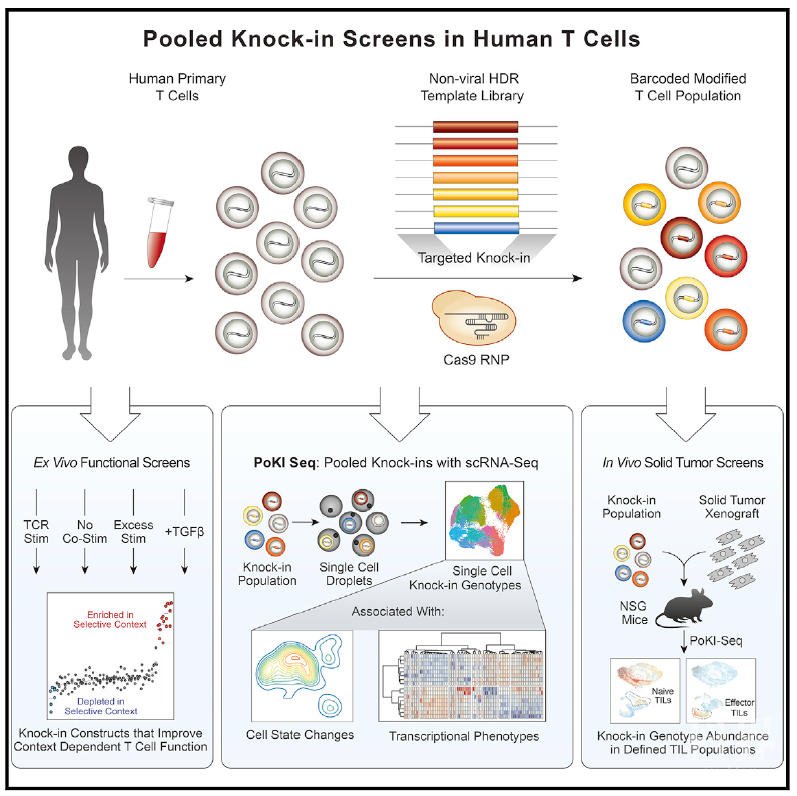
总的来说,文章提出了新型混合基因敲入筛选新方法,同时开发了PoKI-seq测序技术对单个细胞状态和基因结构敲入状况进行记录,能更有效地助力优化细胞免疫疗法。此外,文章揭示出TGF-βR2-4-1BB能够显著提高TCR-T对实体瘤的清除效率,具有潜在的应用价值。
原文链接:https://doi.org/10.1016/j.cell.2020.03.039参考文献
1. Esensten, J.H., Bluestone, J.A., and Lim, W.A. (2017). Engineering Therapeutic T Cells: From Synthetic Biology to Clinical Trials. Annu. Rev. Pathol. 12, 305–330.2. Yamamoto, T.N., Lee, P.-H., Vodnala, S.K., Gurusamy, D., Kishton, R.J., Yu, Z., Eidizadeh, A., Eil, R., Fioravanti, J., Gattinoni, L., et al. (2019). T cells genet- ically engineered to overcome death signaling enhance adoptive cancer immunotherapy. J. Clin. Invest. 129, 1551–1565.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652483933&idx=1&sn=3567998d43c2be751b03b92f380f1e75&chksm=84e222e9b395abff1fdd25803f8c2f47b7fb6de43aaa988d059cbac80fc01dfb3742bb299494#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
武汉植物园“一种调控植物黄酮醇合成的基因及应用”获国家发明专利授权

柔性激光贴膜可用作数字条形码

商品上的条形码,竟能辨别真假?

DNA“条形码”瞄准生物大发现
黑木耳品系和功能开发利用研究取得进展




植物DNA条形码研究获进展

有了靶向和免疫治疗,化疗会被淘汰吗?关于化疗,这些问题你需要知道
水生所关于长江鱼类条形码研究取得新进展

条形码是如何工作的?
条形码中的数学奥秘——二进制