科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-12
来源:BioArt

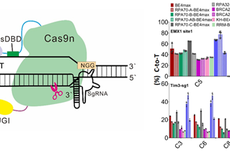
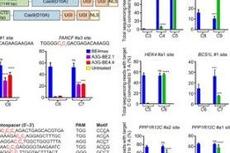
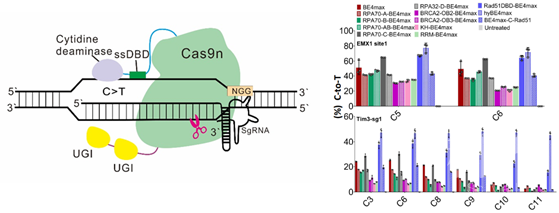 图1. hyCBE模式图及对不同ssDBD的筛选结果
图1. hyCBE模式图及对不同ssDBD的筛选结果向上滑动阅览参考文献
1.Rees, H.A. & Liu, D.R. Base editing: precision chemistry on the genome and transcriptome of living cells. Nat Rev Genet 19, 770-788 (2018).
2.Ran, F.A. et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc 8, 2281-2308 (2013).
3.Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. & Liu, D.R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424 (2016).
4.Koblan, L.W. et al. Improving cytidine and adenine base editors by expression optimization and ancestral reconstruction. Nat Biotechnol 36, 843-846 (2018).
5.Wang, X. et al. Efficient base editing in methylated regions with a human APOBEC3A-Cas9 fusion. Nat Biotechnol 36, 946-949 (2018).
6.Komor, A.C. et al. Improved base excision repair inhibition and bacteriophage Mu Gam protein yields C:G-to-T:A base editors with higher efficiency and product purity. Sci Adv 3, eaao4774 (2017).
7.Wang, L. et al. Enhanced base editing by co-expression of free uracil DNA glycosylase inhibitor. Cell Res 27, 1289-1292 (2017).
8.Thuronyi, B.W. et al. Continuous evolution of base editors with expanded target compatibility and improved activity. Nat Biotechnol 37, 1070-1079 (2019).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652484455&idx=1&sn=1989ea6d4453fdaa583eb352c421d5d2&chksm=84e220d3b395a9c54d7b6ffc22d479e5aa6e470885456d16feef72cdfa7f42d5ad60b5aea618&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国科学院遗传发育所高彩霞研究组开发出高精准胞嘧啶碱基编辑工具
5-氟胞嘧啶核苷

刘耀光院士团队开发高效、广靶向的植物胞嘧啶碱基编辑器PhiCBEs

科研人员开发出高精准胞嘧啶碱基编辑工具

自然中不存在的蛋白质也能人造了!撼动材料医药界
5-氮杂-2'-脱氧胞嘧啶核苷
NCB | 单碱基编辑新突破,开发超高活性胞嘧啶碱基编辑器(hyCBEs)
Science Advances发布一种更精确的胞嘧啶碱基编辑器

遗传所开发出高精准胞嘧啶碱基编辑技术

NBT: ABE单碱基编辑器的新风险——介导胞嘧啶的脱氨基化