科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-23
来源:BioArt
正中隆突(Median Eminence, ME)作为一类室周器,从解剖结构上,位于第三脑室底,介于下丘脑和垂体之间。传统意义的正中隆突被认为是下丘脑和垂体的连接器官,起着传递下丘脑的激素到垂体的作用。作为垂体门脉系统的重要连接部分,它集聚了下丘脑神经元的神经末梢,在轴突末端释放的促生长激素通过正中隆突的毛细血管网运输到垂体前叶,从而调节激素的释放。然而近年来,由于该结构的特殊组成部分,越来越多的工作表明,这个结构可以起着快速传递外周信号给大脑,从而对能量代谢起着精细快速调节的作用。
决定它特殊性的主要有两部分组成:ME内侧,由一类称作Tanycyte的细胞组成,近年来研究发现这类位于第三脑室壁细胞群在脑脊液和脑区间以及血液和脑区间可以快速转运葡萄糖(glucose)和瘦素(leptin)从而使下丘脑的能量感受脑区弓状核(Arcuate nucleus)快速做出反应【1】。ME外侧,则由一群具有通透性的毛细血管网组成,可以运载着大量由全身血液循环中的营养物质或者代谢物。Tanycyte细胞的突起(Process)从ME内侧伸向ME外侧以及下丘脑近第三脑室核团,和通透的毛细血管网组成的正中隆突正因为解剖结构和功能上对能量平衡调节中的特殊性近年来备受关注。代表性发现则是2013年法国内分泌科学家Dr. Vincent Prevot组发现的正中隆起的可塑性可以受到feeding状态的控制【2】。
近日,德国马克斯普朗克代谢所Jens Brüning课题组在Neuron上发表文章MCH Neurons Regulate Permeability of the Median Eminence Barrier,揭示了一类新的调节正中隆突屏障的神经机制。

本文的第一作者姜红,自2015年初加入德国马克斯普朗克代谢所国际著名神经代谢科学家Jens Brüning课题组以来,一直从事着对外侧下丘脑区(Lateral hypothalamus area, LHA)的Melanin-concentrating hormone (MCH) 神经元异质性的研究 (如图1)。在早期利用MCH 神经元报告转基因小鼠进行全脑扫描时发现,这类神经元有大量的位于正中隆突的投射,这一发现作者同时利用了两个独立的报告转基因系(ChR2-EYFP和Synaptophysin-tdTomato)去进行验证,进一步的电镜实验,又在超微结构水平上观察到MCH神经元在正中隆起的神经末梢,和关键性结构Tanycyte的突起非常近邻,甚至在ME外部有些末梢紧靠毛细血管周边,提示有可能具有神经内分泌细胞的作用。这些解剖学证据共同指明了这一从LHA来源的对能量感受和睡眠调节密切相关的神经元很可能通过调节正中隆起的可塑性起到快速感应外周能量信号变化的作用。
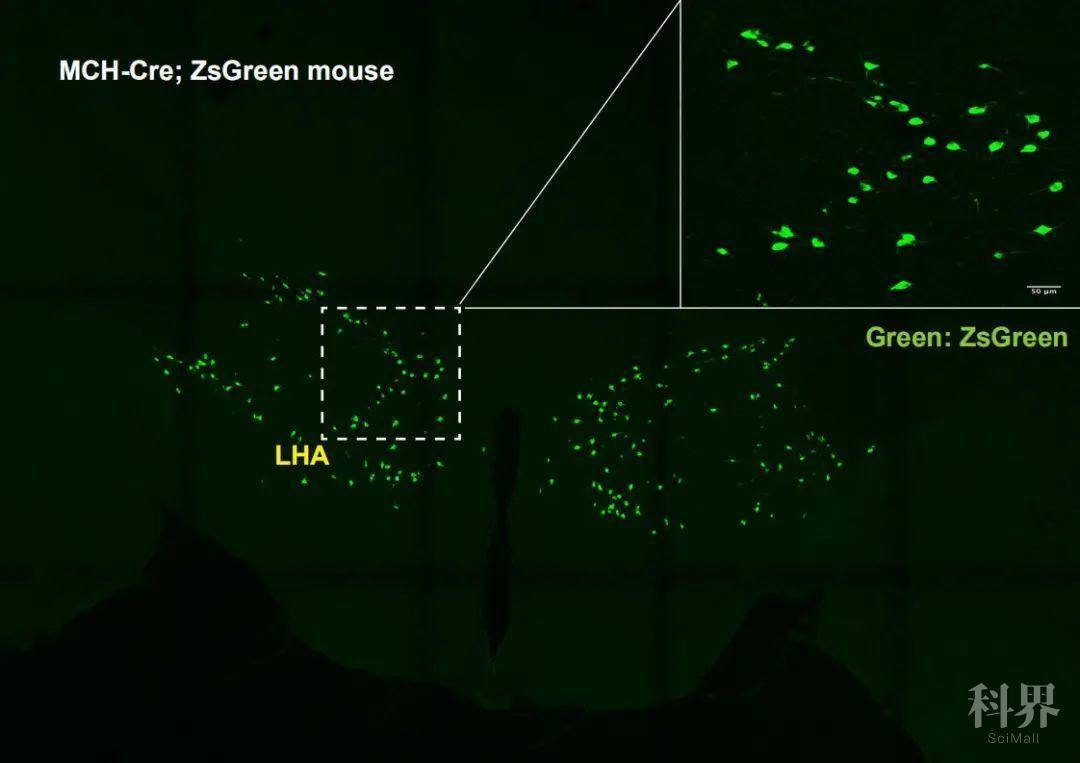
图1:MCH神经元在下丘脑的分布
为了在功能上探索这些在ME的投射是否有调节屏障通透性的作用。作者们首先用了Evans Blue染料-这是一非选择性地结合血液中血清白蛋白的生物分子,结合型的Evans Blue是无法通透血脑屏障(Blood brain barrier, BBB)的。由于ME结构的通透特性,Evans Blue可以顺利通过ME进而进入临近脑区如弓状核。利用这一点作者们分别用了化学遗传学和光遗传学两种模型,来激活MCH神经元和MCH神经元在ME的投射,结果显示,通过测量在弓状核区Evans Blue的扩散程度,MCH神经元的激活可以通过在ME的投射具有增强ME通透性的作用。通过进一步量化ME重要结构的变化,作者们还测量了MECA-32(通透性血管的标记物)和ZO-1(缝隙连接蛋白,Tanycyte复合物结构的标记物),结果表明,同样处理的动物在化学遗传和光遗传实验中都看到了MECA-32的增加,但ZO-1没有改变。这一结果提示,很可能MCH神经元对ME屏障的调节作用,是通过增加该区域的血管的通透性来实现的。这一猜想,又进一步通过电镜实验得到证实,利用化学遗传控制的小鼠,比较了在弓状核区通透性血管和全部血管的比例,相对于对照组,在MCH神经元激活组有明显得通透比例。
上述机制是否能转化为生理意义上的,来源于外周的能量调节关键激素和细胞因子进入大脑的机制呢?作者利用经典的瘦素(Leptin),这一对肥胖和糖尿病机制的理解起着里程碑意义的分子,作为研究MCH神经元是否对ME屏障起调节作用的分子工具。以瘦素抑制食欲作为指标,发现在经历长时间断食的小鼠身上瘦素并不能发挥抑制食欲的作用(这也比较符合生理意义),但是利用化学遗传和光遗传刺激MCH神经元以及MCH神经元在ME的投射发现,相比对照组,MCH神经元可以明显增加短期进食的瘦素的敏感性(重新进食的1小时内),这一结论在免疫荧光量化瘦素下游信号分子STAT3的磷酸化也得到了佐证。
接下来作者感兴趣的是,在解剖结构如此接近的MCH神经轴突末梢和ME内部关键结构(Tanycyte和通透的毛细血管)之间,是否有着直接的神经元-非神经元间相互作用。在体外培养的纯化的Tanycyte细胞中分别进行了MCH肽诱导的经典信号通路(Forskolin和ERK/AKT)和对MCH受体(MCHR1)的检测,结果发现,Tanycyte并不能对MCH神经元释放的MCH肽做出反应。作者们又做了离体ME脑片的钙荧光影像学检测,分别观察了ME结构的Tanycyte细胞层,外部毛细血管层等内部结构对MCH肽,谷氨酸和GABA激动剂(这三个是以往报道的MCH神经元主要释放的递质和神经调节肽)的钙活动,结果都是没有显著反应。这一结果提示,MCH很可能不是MCH神经元在ME投射主要介导分子。接下来为了寻求下游反应靶点以及MCH神经元这一异质性非常强的细胞有哪些可能分泌的因子来介导相关的功能,作者进行了两个关键性实验去寻找答案:
一个是phosphoRiboTrap实验,这一实验原理是利用受到外部刺激的神经元,酪氨酸激酶和G蛋白藕连受体信号通路的激活导致的核糖体上S6蛋白的磷酸化,通过磷酸化S6蛋白的特异抗体免疫沉淀核糖体,并对其进行RNA测序,从而鉴定出unbiased的细胞类型。作者利用这一原理,用化学遗传激活的MCH神经元小鼠1小时后,提取弓状核和ME组织进行核糖体磷酸化蛋白的免疫沉淀,经过RNA测序和统计学上明显激活的下游基因与以发表的弓状核和ME区域的单细胞测序鉴定出的细胞类型进行了系统性比对,鉴定出了几类下游细胞类型,包括:神经元,胶质细胞,还有内皮细胞。
另一个是单细胞核测序,一直以来MCH神经的异质性是众所周知的,已有的报道
表明MCH神经元不但可以分泌MCH肽,还可以分泌可卡因安非他命转录调节肽(Cartpt),同时还可以分泌谷氨酸和γ-氨基丁酸;形态学和电生理功能也都显示其异质性。这也解释了MCH神经元网络在生理调节中的复杂性(饮食、葡萄糖感受等能量代谢,奖赏,睡眠中都起一定作用)。所以如何解析这类复杂细胞群的亚细胞群也一直是揭开MCH神经元复杂网络的关键性问题。作者利用了MCH神经元特异表达的ZsGreen reporter转基因小鼠系,通过分离下丘脑,利用流式细胞仪(FACS)分离出MCH神经元的特异性细胞核,进行了单细胞测序。这一结果第一次利用了unbiased的方法鉴定出了清晰的MCH神经元亚群,并且通过进一步分析也找到了每一类亚群的特异标记分子,为今后的MCH神经元亚群的研究进行了铺垫。有趣的是,通过对各亚型的标志基因表达进行了GO-term分析,作者们发现在Cluster0中,其中一类基因功能为“血管细胞内皮生长因子(VEGF)信号通路的调节”和“内皮细胞增长的正性调节”。
通过以上两个关键性实验,结果共同指向了在MCH神经元表达的VEGF的可能性上,经过转录水平和蛋白水平的系统验证,结果证实,MCH神经元表达一定量的VEGF营养因子,这一结果提示了MCH神经元可能对ME屏障的调节功能机制。因为已有证据表明Tanycyte在断食期间可以大量分泌VEGFA因子来调节ME屏障的通透性,反过来VEGFA的过量表达也可以模拟小鼠在断食期间ME屏障的结构可塑性【2】。基于这个假说,作者用了广谱的VEGF受体信号的抑制剂Axitinib,在化学遗传激活MCH神经元之前,对该信号通路进行阻断,结果发现,MCH神经对瘦素的敏感性调节消失了。
总结该研究结果有两点新意 (如图2):第一,作者发现了一类新的调节正中隆突屏障的神经元机制。第二,继近几年发现MCH神经的非经典调节机制后【3,4】的另一个独立于突触传递外的神经元网络调节机制。
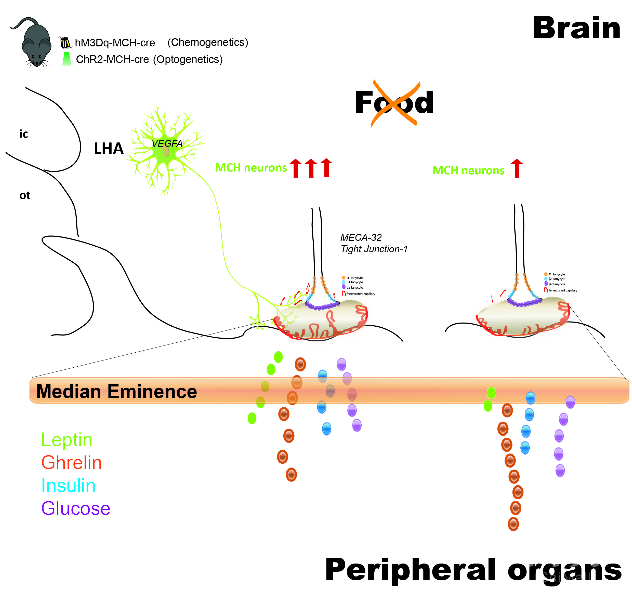
图2:研究假说模型
原文链接:https://doi.org/10.1016/j.neuron.2020.04.020参考文献
1. Martinez, F., Cifuentes, M., Tapia, J.C., and Nualart, F. (2019). The median eminence as the hypothalamic area involved in rapid transfer of glucose to the brain: functional and cellular mechanisms. J Mol Med (Berl) 97, 1085-1097.2. Langlet, F., Levin, B.E., Luquet, S., Mazzone, M., Messina, A., Dunn-Meynell, A.A., Balland, E., Lacombe, A., Mazur, D., Carmeliet, P., et al. (2013). Tanycytic VEGF-A boosts blood-hypothalamus barrier plasticity and access of metabolic signals to the arcuate nucleus in response to fasting. Cell Metab 17, 607-617.3. Conductier, G., Brau, F., Viola, A., Langlet, F., Ramkumar, N., Dehouck, B., Lemaire, T., Chapot, R., Lucas, L., Rovere, C., et al. (2013). Melanin-concentrating hormone regulates beat frequency of ependymal cilia and ventricular volume. Nat Neurosci 16, 845-847.4. Noble, E.E., Hahn, J.D., Konanur, V.R., Hsu, T.M., Page, S.J., Cortella, A.M., Liu, C.M., Song, M.Y., Suarez, A.N., Szujewski, C.C., et al. (2018). Control of Feeding Behavior by Cerebral Ventricular Volume Transmission of Melanin-Concentrating Hormone. Cell Metab 28, 55-68 e57.来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652485664&idx=6&sn=3b4b7bdf5934d069e7b57a8e1616862b&chksm=84e22b94b395a2829bc17bd2c1a67b5befffc280c990ce546a609359b100071c774e6a5b50ef#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
脑损伤激活胶质细胞产生神经元研究获进展

Cell:星形胶质细胞保护神经元免受毒素累积
星形胶质细胞首次转为功能性神经元

人类皮肤细胞直接“变身”运动神经元

金纳米粒子保护神经元免于细胞死亡
生长激素居然有个隐藏功能——阻止你减肥!

Cell:科学家从下丘脑“揪出”体重控制基因—SEMA3A

经典论文:癌细胞的行为类似于神经元
揭秘癌细胞与神经元的“共生共舞”
简单小分子组合实现胶质细胞直接转化为神经元