科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-29
来源:药学进展
原标题:中国医学科学院药物研究所戴均贵团队在天然产物生物合成相关分子间[4+2]环加成反应环化酶研究中取得突破性进展
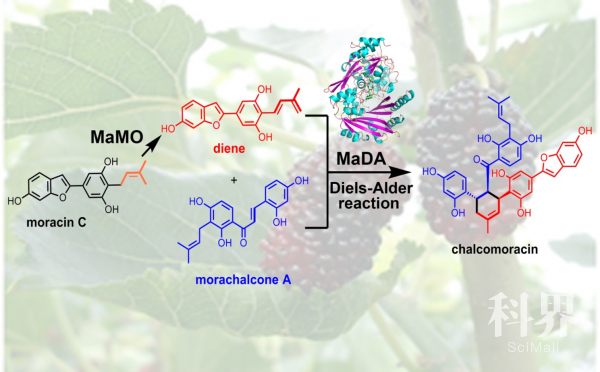
2020年5月26日,Nature Chemistry在线发表中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室、北京大学化学与分子工程学院以及中国中医科学院中药资源中心合作完成的题为FAD-dependent Enzyme-catalysed Intermolecular [4+2] Cycloaddition in Natural Product Biosynthesis 的研究论文,报道了自然界中首例催化分子间[4+2]环加成反应、单功能Diels-Alderase(环化酶)。
Diels-Alder反应是一种共轭二烯体和亲二烯体之间的协同[4+2]环加成反应,为有机合成化学中选择性构筑碳-碳键及复杂碳环的重要方法之一。Diels-Alder反应存在于众多天然产物生物合成过程中,造就了天然产物结构及生物活性的多样性,相关Diels-Alderase一直引起科学家的高度关注。目前报道的Diels-Alderase多为催化分子内Diels-Alder反应、多功能酶,且多来源于微生物,而来源于植物、催化分子间Diels-Alder反应的单功能Diels-Alderase尚无报道。植物源天然产物生物合成相关基因往往不成簇,已报道的Diels-Alderase多分属不同酶家族、无系统进化上的相关性,发现困难。
该研究基于酶活性的蛋白分离纯化、蛋白质组及转录组学、生物合成中间体探针 (biosynthetic intermediate probe)等多技术相结合,从桑培养细胞中发现并鉴定了一FAD依赖的单加氧酶MaDA,能高效、严格立体选择性地催化分子间[4+2]环加成反应形成典型的环己烯结构单元,且对二烯体及亲二烯体均具较宽的底物谱;同时鉴定了另一FAD依赖的单加氧酶MaMO能催化异戊烯基氧化形成二烯体,二者共同完成了桑中chalcomoracin等异戊烯黄酮类Diels-Alder加合物生物合成关键反应(图1)。密度泛函理论计算(DFT)及动力学同位素效应(KIE)实验显示该反应为协同、非同步的周环反应,结构生物学结合定点突变阐明了[4+2]环加成反应过程中底物与酶之间相互作用的分子机理。MaDA为自然界中首例催化分子间[4+2]、单功能Diels-Alderase,它的发现不仅揭示了桑中Diels-Alder加合物生物合成途径中关键反应的酶学机制,而且为天然产物生物合成未知关键酶的发现提供了借鉴,同时还为结构多样药用天然产物高效立体选择性酶化学法合成提供了强有力工具。
信息来源:中国医学科学院药物研究所院校新闻
信息链接🔗:
http://www.pumc.edu.cn/blog/%e3%80%90%e5%8c%bb%e5%ad%a6%e4%b8%8e%e5%81%a5%e5%ba%b7%e7%a7%91%e6%8a%80%e5%88%9b%e6%96%b0%e5%b7%a5%e7%a8%8b%e8%bf%9b%e5%b1%95%e5%bf%ab%e6%8a%a5%e7%ac%ac74%e6%9c%9f%e3%80%91%e8%8d%af%e7%89%a9%e7%a0%94/
来源:ppsyxjz 药学进展
原文链接:https://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651309370&idx=2&sn=fa51f4a8aa6411b618df2f137012ec5e&chksm=8bf49336bc831a20fd87647982a69d8a1d80665e7fd24e30997457402d4887b1de22cd88483b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

张鹏研究组合作揭示木脂素生物合成关键酶的分子机制
微生物所在流感病毒聚合酶调控RNA合成机制研究领域取得进展



中国学者在植物天然产物生物合成与酶学研究领域取得新进展

酶促DNA合成研究获进展
化学所在谷氨酸合成酶的生物电化学研究方面取得新进展

基于分子筛生物界面的多相酶催化

科学家发现饥饿素抑制分子,可用于治疗糖尿病厌食症
化学所李峻柏课题组实现硼酸分子作为化学燃料驱动生物分子马达ATP合酶的能量合成
酶单分子纳米胶囊技术生物传感器研究获进展
材料进展:科学家合成超级酶可快速分解塑料