科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-30
来源:X一MOL资讯
精准的蛋白质化学修饰是近年来化学生物学领域的研究热点之一。蛋白质的定点修饰可以调控或改变蛋白质的性质和功能,对构建抗体药物偶联物也极具意义。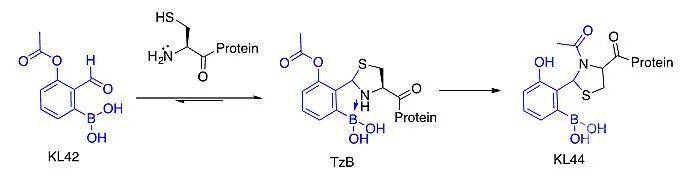
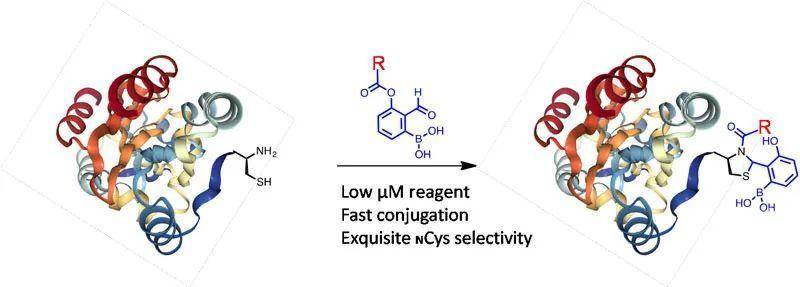
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657638388&idx=6&sn=8ec80c0c9288a41d6f5ba20c28a818e7&chksm=80f87e24b78ff732844a6e0f86e8136410fe1400c3d5494b05cf49662e0e77ed2cd304ca073f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
人类肠道每天能吸收300亿噬菌体
姜还是老的辣:噬菌体VS超级细菌

噬菌体疗法有助治疗泛耐药菌感染

致敬Sydney Brenner (1927-2019)——但开风气亦为师

细菌休眠机制抑制噬菌体蔓延

芬兰教授建议用噬菌体疗法对付“超级细菌”

昆明植物所在天然产物肿瘤免疫化学生物学研究中取得进展
Cell Chem Biol | 化学生物学助力开发新型抗胶质母细胞瘤抑制剂

噬菌体协助细菌帝国之间建立“界限”

蛋白激酶化学生物学研究获进展