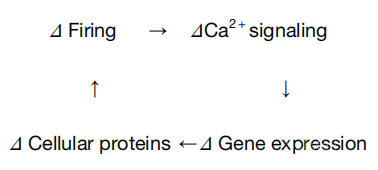来源:iNature
稳态指机体通过调节作用维持自身相对稳定的一种状态。神经系统中神经元也存在稳态调节,即稳态可塑性。当神经元的突触传递或兴奋性持续抑制或激活时,神经元会代偿性地向相反的方向进行调节,使得神经环路维持在相对稳定的水平,避免过度的沉默及失控的激活,保证神经元和神经环路正常的信息传递。稳态可塑性参与了许多重要的生理功能和脑疾病机制,例如觉醒-睡眠周期,自闭症、精神分裂症等神经/精神疾病。但是,目前对于神经元兴奋性稳态的研究还比较有限。
早在近30年前,19世纪90年代,有研究者提出神经元兴奋性稳态反馈环路的假说:神经放电的持续变化,会通过钙信号通路的改变影响基因表达进而导致蛋白层面的改变,从而反馈调节神经元的兴奋性。2020年6月2号,中山大学的李勃兴实验室和纽约大学的Richard W. Tsien(钱永佑)实验室共同通讯在Cell 在线发表文章“Neuronal Inactivity Co-opts LTP Machinery to Drive Potassium Channel Splicing and Homeostatic Spike Widening”,发现了兴奋性稳态可塑性的分子机制,为这个假说环路提供了完整的实证。

该研究采用APD(Action potential duration,动作电位时程)作为神经元活动性/兴奋性指标。用钠通道阻滞剂TTX(Tetrodotoxin)慢性阻断原代培养神经元的钠离子通道模拟神经元活动性慢性降低,验证了活动性慢性降低会代偿性引起APD延长、AP诱发钙瞬变的幅度和时程增加。考虑到复极化过程主要与钾离子通道有关,研究者用BK阻滞剂IbTx阻断钾通道BK,模拟了TTX诱导的APD的增加。而且在TTX慢性阻断的基础上再加IbTx对APD无影响,提示神经元活动性降低可能通过减弱BK的作用,反过来提高神经元活动性。
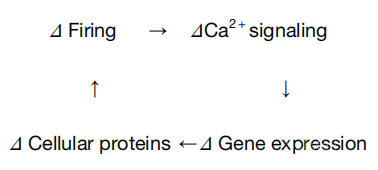
图1:19世纪90年代提出的一个经典的神经元兴奋性稳态反馈环路(图源自Cell )
关于神经元活动性慢性降低如何影响BK,研究者考虑了是否是因为降低了BK基因层面的转录、翻译或者蛋白质层面的运输,但实验发现都没有差异,于是研究者探索了可变剪接层面的变化。BK可能在X1到X6这几个位点进行可变剪接(图2),其中只有X6对应的29号外显子E29的剪接会受到神经元活动性改变的影响。加入TTX慢性降低神经元活动性时,BK更倾向于把E29丢掉。但奇怪的是用高钾诱导神经元慢性去极化也可以降低E29的剪接,活动性慢性降低和激活对剪接的影响方向竟然是一致的。读者们可以先记住这个问题,后面会进行讨论。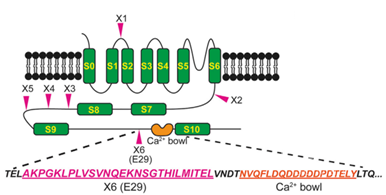
图2:BK通道组成孔道的α亚基及可变剪辑位点(图源自Cell )
E29位于钾离子电导调控结构域(K+conductance domain, RCK domain),离一个钙离子结合位点(Ca2+ bowl)很近(图2),后者可以促进BK通道的激活。那么E29的跳脱是否会影响BK的电流?果然,缺失E29的isoform(△E29)过表达使BK通道电流降低,APD增加,提示E29剪接下调介导了神经元活动性降低对BK通道和APD的影响。
那么E29的可变剪接是如何被调控的?一般剪接调控因子结合在外显子下游内含子区的时候可以促进外显子的保留。研究者在E29的下游发现了YCAY簇,和剪接调控因子Nova的结合位点的序列一致,然后通过RNA pull-down和RNA IP分别从体外体内水平验证了皮层中Nova的主要亚型Nova-2可以结合于E29的下游内含子区。神经元敲低Nova-2后E29下降,但可以被外源补充Nova-2所挽救,而且Nova-2敲低后阻止了TTX对E29剪接的影响,说明Nova-2参与到TTX诱导E29跳脱的通路中。
先前研究表明Nova-2定位在细胞核内时才有调控E29剪接的功能,这可能是神经元活动性降低对Nova-2功能的一种调控机制。研究者发现神经元加入TTX促使核内的Nova-2向核外转移。个体层面上,用毒素TeTox阻断丘脑Olig3阳性神经元向大脑皮层特定神经元的兴奋性投射,导致Nova-2向核外转运。另外,通过单眼剥夺范式,在小鼠视觉发育关键期缝合单侧眼睑,减少对对侧V1区神经元的兴奋输入,观察到对侧V1区神经元的Nova-2向核外转运,E29剪接下调,APD增大。体外体内试验证明神经元活动性慢性降低通过诱导Nova-2从胞核向胞质转运,从而减少E29剪接,上调APD。这里同样出现了一个奇怪的相似性,神经元活动性慢性降低和激活对Nova-2细胞亚定位的影响也是一致的,提示Nova-2亚定位层面或是更上游的层面开启了这样的一致性。
Nova-2细胞亚定位的上游是什么呢?还没有文献探究过上游的细胞机制,研究者猜想是通过磷酸化来调控。研究者选择了CAMKIV,一个主要定位在细胞核里的磷酸激酶,被报道可以调控其他一些剪接因子,而且参与稳态调节。加入TTX后,以及单眼剥夺造模后,CAMKIV重要活性位点196位苏氨酸磷酸化在核内的蛋白含量增加。过表达持续激活的CAMKIV(CA-CAMKIV)促进nova-2向核外转运,而通过CaMBP4(nuc)抑制核内CAMKIV的激活则阻止了TTX介导的Nova-2核外转运,说明神经元活动性降低诱导的核内CAMKIV激活介导了nova-2的亚定位改变。
TTX如何诱导CAMKIV的激活?TTX可以阻断诱发型的囊泡释放但是不会阻断自发的非AP依赖的囊泡释放。这种自发的突触传递是否足以激活CAMKIV通路呢?为此,研究者通过ASAP1,一种基因编码的膜电位探针,来监测树突棘的膜电位,发现慢性TTX阻断引起的自发性树突棘去极化程度足以诱发L型钙离子通道以及NMDA受体介导的钙离子内流。进而检测钙内流情况,慢性TTX阻断的情况下树突仍然可以检测到钙内流,而且比起对照组有更强的钙瞬变。 研究者猜想可能是含GluA1亚基的AMPA受体介导了活性阻断后钙瞬变的增强。实验观察到活动性减弱的神经元膜上GluA1水平增加,添加PhTx阻断GluA1后,钙瞬变减弱,而且完全阻滞了TTX对APD的影响。另外,NMDA受体拮抗剂APV,内质网钙离子转运抑制剂Thapsi消耗胞内钙离子存储,L型钙离子通道(CaV1)拮抗剂Nimo,都减弱了TTX对钙瞬变的影响,提示AMPA受体介导的钙内流引起树突棘膜电位去极化,继而引发NMDA受体和CaV1的钙内流作用。 现在环路中剩下的最后一环是,突触后膜上CaV1的激活是如何与细胞核内的可变剪接联系在一起的。神经元正常去极化后的兴奋-转录藕连(Excitation-transcriptioncoupling, E-T coupling),是通过shuttle proteins(γCaMKII或γCaMKI)将钙离子/钙调蛋白转运进核内激活CAMKIV,从而启动转录调控。为了确认兴奋-可变剪接藕连(Excitation-AS coupling)的shuttle protein,研究者以TTX慢性阻滞后核内含量增高而胞质含量降低为标准,筛选出了βCAMKK蛋白。βCAMKK敲低阻止了TTX对E29剪接的影响,再表达βCAMKK后又恢复,说明βCAMKK向核内的转运介导了神经元活动性降低对可变剪接的调控。
研究至此已经整理出了钙信号通路CaV1-CaMKK-CaMKIV cascade。研究者通过对CaV1、CAMK和CAMKK的阻滞后挽救实验,综合验证了这条通路。另外,高钾诱导直接去极化同样有相似的表现。前面遗留的问题读者可能心里有答案了:神经元活动性慢性降低导致去极化的增强,而不管去极化是由神经元活动性慢性降低还是高钾诱导引起,CaV1和CaMK家族通路的活化都会介导Nova-2的重新分布以及E29的剪接改变。

文章模式图(图源自Cell )
最后为大家梳理一下整个通路。在神经元慢性活性抑制的情况下,树突棘GluA1上膜增加,AMPA受体介导去极化的作用增强,加上钙离子通道和NMDA受体的激活,钙内流增强,促进βCAMKK入核,磷酸化核内的CAMKIV,再磷酸化Nova-2,使Nova-2出核,无法发挥对钾通道BK外显子E29的剪接调控作用。于是E29被跳脱了,导致钾通道BK作用减弱,于是APD增加,表示神经元活动性被激活了,完成整个负反馈自调控的稳态环路(图3)。该研究第一次完整实证且丰富了30年前的神经元兴奋性稳态可塑性假说,尤其是发现了可变剪接在稳态可塑性中的作用,填补了相关研究领域的空白。而且,该通路中的每一环,以及涉及到的大部分基因都与神经/精神疾病有关,例如孤独症、精神分裂症等,提示了未来脑疾病机制研究的新方向。
启发与问题:1、我们从该研究中可以发现,兴奋性稳态调节的信号通路与高钾直接诱导去极化的信号通路非常相似,研究者尚未探讨二者在分子机制上的区别。所以,兴奋性持续降低的负反馈调节和高钾诱导兴奋性增强,是共用了同一段信号通路,还是这两条看似相同的通路间存在着细微但重要的差异?这样的分子机制差异又会在神经元和神经环路层面产生什么不同的影响?
2、其实在信号通路的第一步——神经元活动性慢性降低导致GluA1上膜增加,就可见负反馈激活神经元兴奋性的端倪了,信号通路的后面部分主要阐释了膜上发生的“端倪”如何一步步“联动”到APD上。那么笔者其实很好奇,神经元活动性慢性降低是如何导致GluA1上膜增加呢?完善这一块分子机制的研究,可以进一步靠近神经元兴奋性稳态的本质。
3、该研究第一次揭示了可变剪接在稳态可塑性中的重要作用,展示了可变剪接对于神经系统的重要性。一般情况下,第一步如果没有观察到蛋白分子在转录、翻译和蛋白质分布多个层面上的差异时,研究者很可能放弃这个分子。但实际上可变剪接可能比转录翻译水平的改变更适合神经系统复杂的可塑性变化,应该被我们留意到。
4、本文研究的通路长而繁杂且完整,但仍然思路清晰、逻辑性强,令人佩服。尤其是主线+辅线(文中时而出现的“奇怪问题”)的讲述方式,最后合二为一,颇有“草蛇灰线”之感,读起来十分有趣。来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247510992&idx=6&sn=7869a21ecca10b54fa82e07302376391&chksm=fce6d80fcb91511906531e93d30ebdad08a72b3fa80eaaa93f9b05b6e27a1e444ccd94968ef7#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn