来源:X一MOL资讯
英文原题:Therapeutic Delivery to the Brain via the Lymphatic Vasculature
通讯作者:陈永明,刘利新,中山大学材料科学与工程学院
作者:Pengfei Zhao(赵鹏飞),Zhicheng Le(乐志成),Lixin Liu(刘利新),Yongming Chen(陈永明)
脑胶质瘤和神经退行性疾病等中枢神经系统疾病死亡率高,治疗难度大,治疗费用高昂。针对中枢神经系统疾病的系统给药功效很差,根本原因在于静脉注射和口服等常规给药途径无法使药物通过运输过程中的各种屏障,而其中最难以克服的就是血脑屏障(Blood-Brain Barrier)。为解决血脑屏障给脑部药物输送带来的困扰,有研究学者尝试采用多肽、毒素或超声等手段,永久或暂时性的打开血脑屏障。然而这些尝试存在极大的危险性,且无法用于重复给药。
因此,开发安全高效的新型脑部药物递送策略,成为中枢神经系统领域的重要研究目标。中山大学材料科学与工程学院陈永明教授团队通过大胆尝试,提出一种高效率的中枢神经系统药物递送策略——通过脑部淋巴系统进行载药纳米颗粒输送。研究以装载吲哚菁绿(ICG)的聚合物纳米颗粒为药物输送模型,通过颈部皮下给药以后,颗粒会高效地汇集至注射部位附近的深层颈部淋巴结,并进一步通过脑膜淋巴管运输,46纳米的颗粒实现了高达8.8%的脑部递送效率,远高于静脉注射到达脑部的效率。最终通过光动力疗法实现了对小鼠原位脑胶质瘤的显著抑制,延长了治疗生存期。这一突破性的药物递送策略,摆脱了传统给药途径中遇到的各种复杂难题,并绕过了血脑屏障,开启了中枢神经系统疾病治疗的新篇章。
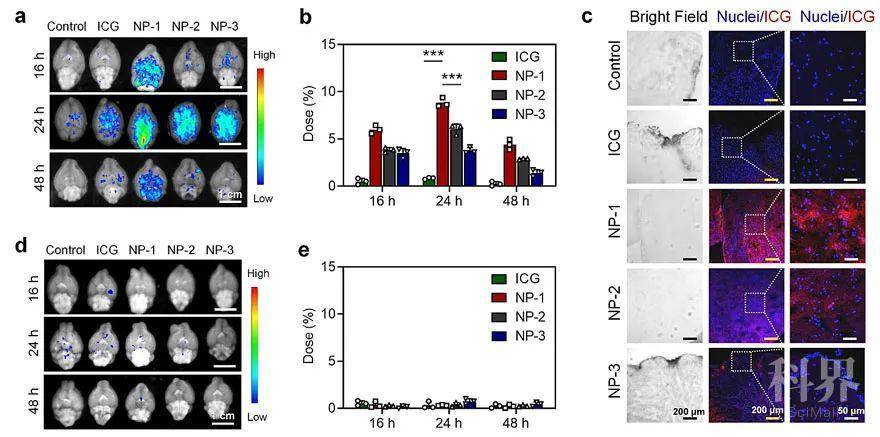
图1. 纳米颗粒在正常小鼠脑部的分布。(a-b) 颈部皮下给药后,游离ICG和纳米颗粒在脑部的分布情况;(c) 颈部皮下给药24 h后,游离ICG和纳米颗粒在脑实质中的分布(蓝色荧光为细胞核,红色荧光为ICG);(d-e) 尾部静脉给药后,游离ICG和纳米颗粒在脑部的分布情况。团队首先探究了中枢神经系统淋巴结构介导纳米颗粒进入脑部的效果(如图1所示)。为此,制备了具有三种粒径的聚合物纳米颗粒(NP-1:46 nm;NP-2:113 nm、NP-3:181 nm),并将装载了ICG的纳米颗粒注射到小鼠颈部皮下(靠近颈部浅表和深层淋巴结)。通过在小鼠脑部荧光成像监测、组织定量和脑实质切片观察发现,游离ICG和纳米颗粒实现的脑部递送效率在24 h达到最高点。其中NP-1凭借出色的淋巴引流效果,实现了8.8%的脑部药物递送效率,是静脉给药后脑部递送效率的44倍。
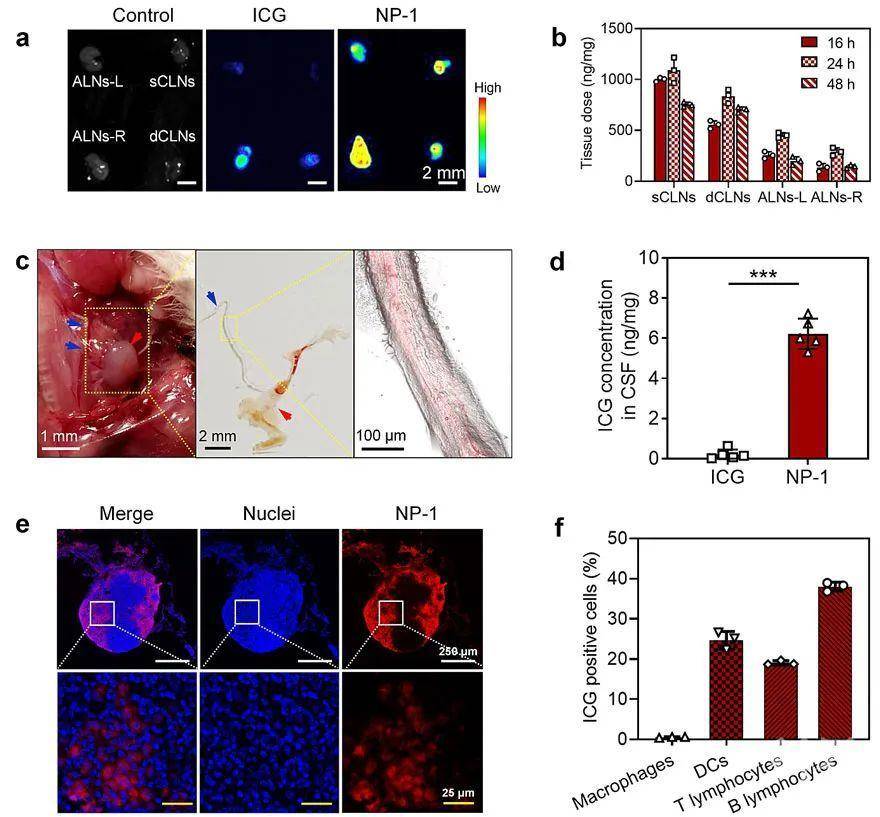
图2. NP-1在注射部位近端淋巴结和脑膜淋巴管的分布。(a-b) 皮下给药后NP-1在小鼠近端淋巴结的分布;(c) 皮下给药24 h后,NP-1在颈部深层淋巴结(红色箭头)和脑膜淋巴管(蓝色箭头)的分布情况;(d) 皮下给药24 h后,小鼠脑脊液中ICG或NP-1的定量浓度;(e) 皮下给药24 h后,通过淋巴结冷冻切片观察NP-1在小鼠颈部深层淋巴结中的具体分布。(f) 皮下给药NP-1后24 h,颈部深层淋巴结中呈ICG信号阳性的免疫细胞比例。然后团队探究了纳米颗粒通过中枢神经系统淋巴结构将药物递送至脑部的机制。如图2所示,颈部皮下给药后,NP-1在小鼠颈部深层淋巴结的累积量不断增加并在24 h达到峰值(829 ng/mg),且这种累积效果明显要优于游离的药物分子,原因在于小分子偏向于从组织间隙的毛细血管进入血液,而大分子和纳米颗粒则优先进入淋巴系统。而直接连结了颈部深层淋巴结的脑膜淋巴管中也检测到强烈的荧光信号,表明NP-1通过脑膜淋巴管向脑部进行药物输送。作为直接反映药物脑部递送效率的重要参数,脑脊液中NP-1所装载药物的浓度在皮下给药后达到6.2 μg/mL,远高于游离药物实现的递送效果(0.1 μg/mL)。而免疫细胞的ICG荧光信号检测则表明纳米颗粒极有可能通过免疫细胞运输将NP-1持续不断的运送至脑部,最终揭示了颈部深层淋巴结累积-脑膜淋巴管运输-脑部递送的药物递送途径。
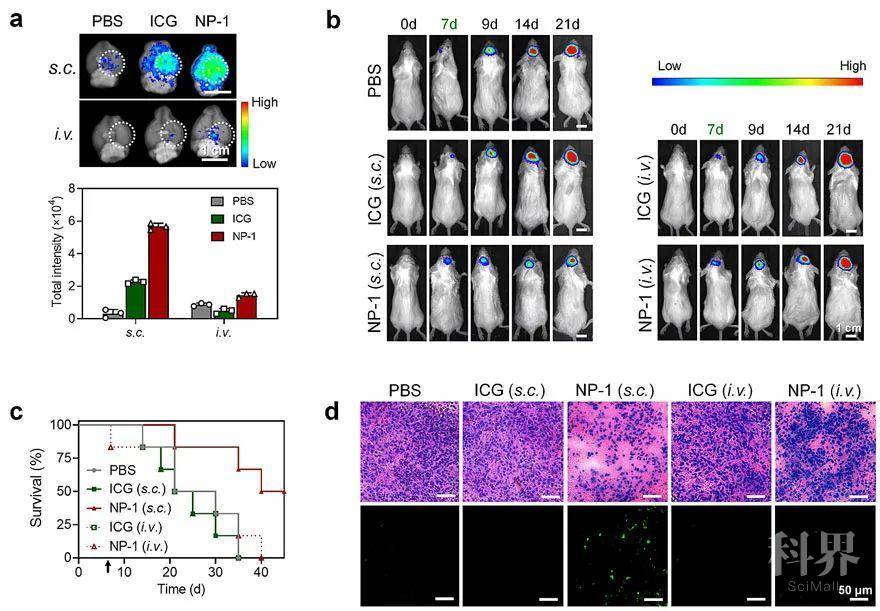
图3. NP-1通过脑部药物递送实现对小鼠原位脑胶质瘤的光动力治疗。(a) 颈部皮下或尾静脉注射游离ICG和NP-1后,药物在荷有原位脑胶质瘤小鼠的脑部分布情况;(b-d) 经过不同药物疗法后,小鼠脑胶质瘤的生长情况(脑胶质瘤细胞经生物荧光标记)、荷瘤小鼠的生存率及脑胶质瘤组织被破坏的效果。最后,团队构建了一种小鼠原位脑胶质瘤模型,作为脑部淋巴结构递送药物并用于中枢神经系统疾病治疗的应用实例。如图3所示,皮下给药的NP-1能够高效地递送至小鼠脑部,且更偏向于富集在具有炎症的脑胶质瘤部位;经过光动力治疗后,皮下给药的NP-1也能够较好的抑制脑胶质瘤生长,促进肿瘤细胞凋亡坏死,并显著提高荷瘤小鼠生存期。
这一成果于近期发表在Nano Letters 上,中山大学材料科学与工程学院博士后赵鹏飞为该研究第一作者,博士研究生乐志成为文章的共同第一作者,陈永明教授和刘利新副教授为该研究通讯作者。该研究得到了国家自然科学基金(51533009)、广东省创新创业研究团队项目(2013S086)和广东省自然科学基金(2014A030312018)的支持。
陈永明教授科研团队从事聚合物材料化学和纳米药物输送工程研究。通过实现载药颗粒的高可控性、可规模化制备,开展纳米亚单位疫苗和纳米佐剂、口服药物递送、脑部药物递送研发,并且发展聚合物材料抑制游离核酸引起的自身免疫性疾病新策略。
Therapeutic Delivery to the Brain via the Lymphatic VasculaturePengfei Zhao, Zhicheng Le, Lixin Liu*, Yongming Chen*Nano Lett., 2020, DOI: 10.1021/acs.nanolett.0c01806Publication Date: June 8, 2020Copyright © 2020 American Chemical Society
导师介绍陈永明https://www.x-mol.com/university/faculty/15404(本稿件来自ACS Publications)来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657642791&idx=2&sn=b83e4d46c587a0b7a5ca2fcae4be0869&chksm=80f840f7b78fc9e172ccdcd59ed731b5726b7809098f047dbc2be3edb898ec6f4acd782bfd30&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn