科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-26
来源:brainnews
Fas又称CD95,是由325个氨基酸残基组成的受体分子,广泛表达于包括淋巴细胞在内的多种细胞表面,分子胞内段带有特殊的死亡结构域,与配体结合启动致死性信号转导,最终引起细胞死亡。Fas活化在多种神经障碍中存在,并能够同时导致细胞凋亡和促进存活。
然而我们对Fas信号如何在海马区动态运转知之甚少。信号网络的光遗传学解剖可以为细胞的应答或命运,包括众多疾病中出现的信号传递障碍,给出分子水平解释。Won Do Heo团队在Science Advances上发表文章Dynamic Fas signaling network regulates neuralstem cell proliferation and memory enhancement,开发了一种光遗传学可激活的Fas, 该Fas以合理的生理学方式起作用。哺乳动物齿状回未成熟神经元中的Fas活化引发哺乳动物帕雷霉素靶点mTOR激活及随后的脑源性神经营养因子分泌。持久的Fas活化诱导神经干细胞外的信号调节酶Erk磷酸化。这种信号网络的重复激活导致小鼠神经干细胞增殖并短暂增加空间工作记忆。该研究证实了一种齿状回新型Fas信号网络,并阐明了该信号网络对成年神经发生和记忆增强的影响。
Won Do Heo是韩国科学技术院生物科学与工程学教授,其团队主要利用生物成像,光遗传学和化学遗传学等技术,研究多种细胞及动物的生物现象和细胞功能,涵盖细胞生长,迁移,死亡,癌细胞代谢及大脑功能等。光遗传学技术是疾病相关病理机制研究的重要工具,应用极广。

建立光遗传学激活性Fas受体
光遗传学是一项整合了光学、软件控制、基因操作技术、电生理等多学科交叉的技术。2005年,斯坦福大学Karl Deisseroth实验室通过在神经细胞中表达光敏蛋白,响应不同波长的光刺激实现对神经功能的调控,从而使生物体内发生的变化可视化,宣布人类正式拥有了精准操控大脑的工具。长久以来,我们对复杂的神经网络连接的理解仅停留在相关性上,有了光遗传学,我们终于有能力微创、精准地探究特定的神经环路和大脑功能之间的关系,这无疑是跨越式的进步。
该研究开发了一种光遗传学技术可激活的生理学可信性Fas模块(optoFAS)(图1),该模块包含膜结合序列(Lyn),Fas的细胞质域(cyFAS),隐花色素2的PHR域(CRY2PHR,波长488nm)和增强的绿色荧光蛋白(EGFP)组成。该模型能够同时诱导特定类型细胞的凋亡和非凋亡信号转导,并引起相关下游蛋白酶的激活。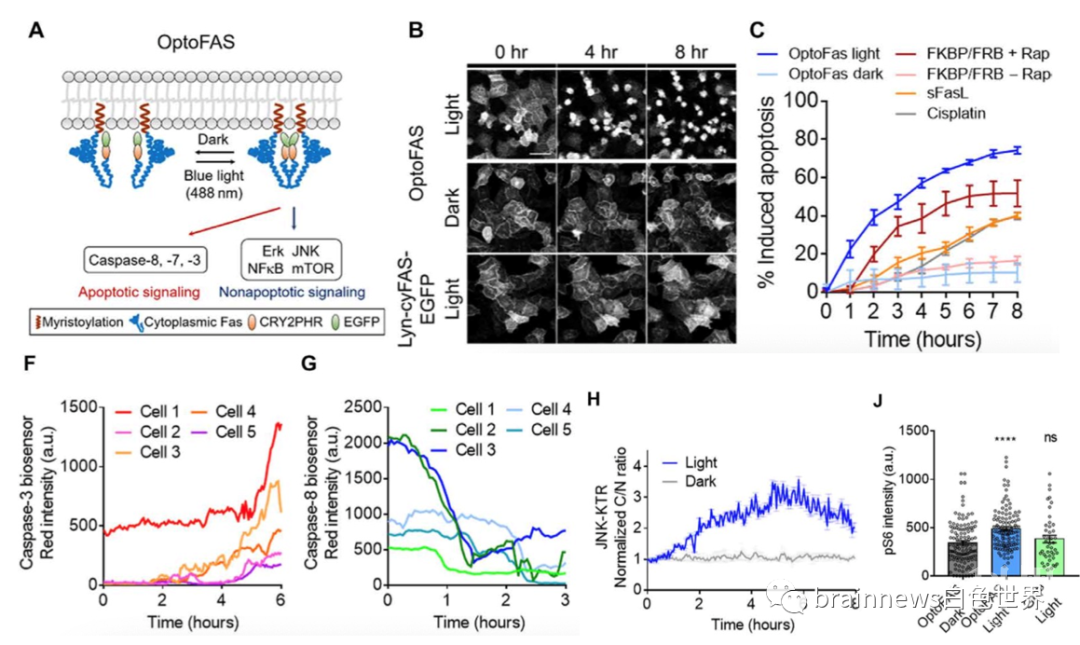
图1. 光遗传学可激活的Fas受体的开发和验证
2
光遗传学激活揭示齿状回中动态Fas信号网络
为了探索认知和记忆环境下大脑中Fas信号动态变化,腺相关病毒被注入8周龄小鼠的海马齿状回(DG)中,3周后在DG未成熟神经元中表达。通过光刺激Fas转导区域可诱导下游信号成分不同的激活模式(图2)。其中AKT-mTOR通路成分pS6细胞光照0.5小时即被最大化激活,而缺乏optoFAS海马齿状回颗粒下层(SGZ)的pErk细胞在照射4个小时后才被最大化激活。在optoFAS转导的小鼠腹膜内注射mTOR通路阻抗剂雷帕霉素能够抑制颗粒细胞层(GCL)pS6细胞和SGZ pErk细胞活化。表明Fas介导的未成熟神经元中mTOR通路的激活与神经干细胞中pErk水平的后续升高相关。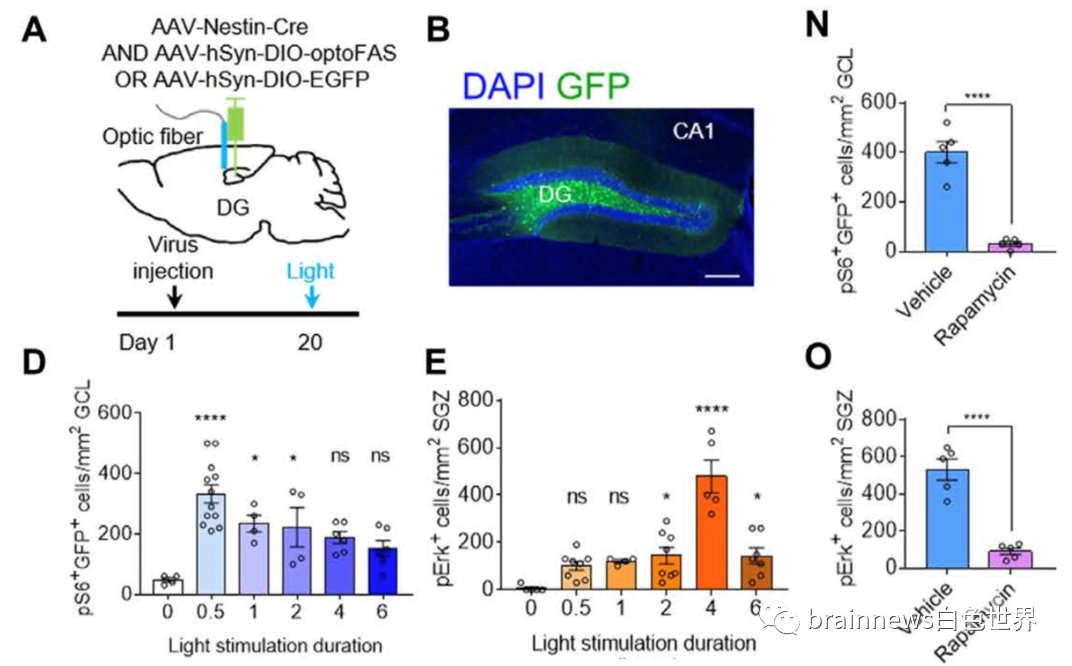
图2. DG区光遗传学可激活的Fas动态信号网络
3
Fas信号网络的动态活化在神经系统疾病中的作用
该研究将不同组别按照Aβ状态又分别分成了不同亚组。模拟准确率在Aβ阴性(Aβ-)个体中依然很高。分别单独分析MCI Aβ-个体和CN Aβ-个体(脑脊液 Aβ没有升高且不携带APOE4等位基因)时,这种准确率依然存在,提示在认知正常个体中少量的tau播散是存在的。
4
区域Aβ负荷影响区域的模型表现
Fas激活后,未成熟神经元细胞分泌脑源性神经营养因子(BDNF),胰岛样生长因子1(IGF-1)强劲增加,而白细胞介素-6(IL-6)表达降低。给予mTOR抑制剂雷帕霉素能够pS6水平及BDNF mRNA的表达,将BDNF/原肌球蛋白受体酶B(TrkB)抑制剂应用到optoFAS小鼠中,光刺激后,SGZ中pErk+细胞数量显著减少,支持来自未成熟神经元的BDNF诱导神经干细胞中pErk激活的假说。而使用雷帕霉素阻断mTOR途径则显著降低了光刺激后BrdU +细胞的数量,证实了这种成年神经发生是由本文揭示的新型Fas信号网络诱导。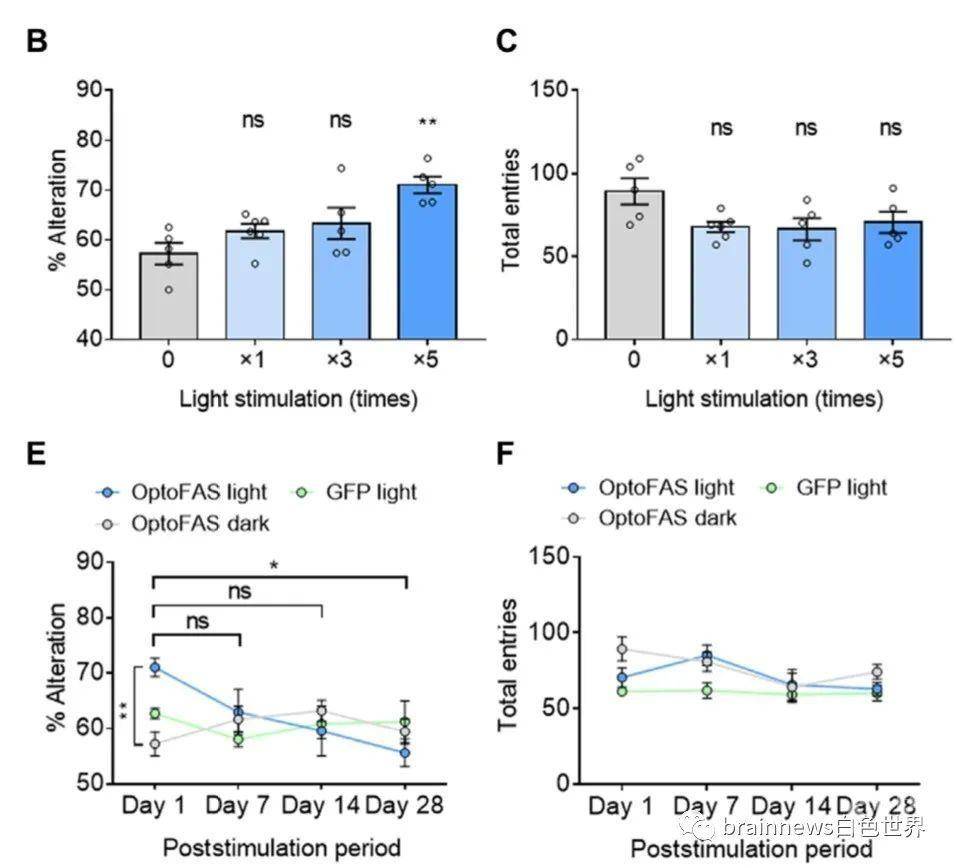
图3. 重复激活Fas信号网络可短暂提高空间记忆
5
总结及展望
本研究首次利用光遗传学解剖演示DG信号的瞬时动态变化,发现了DG有关未成熟神经元和神经干细胞之间通讯的新型Fas信号网络,即未成熟神经元中Fas的短暂激活仅仅活化mTOR通路,而持久激活既可介导未成熟神经元中mTOR通路,又可通过BDNF的分泌介导缺乏Fas表达的神经干细胞中ERK通路。光遗传学研究可以实现Fas信号通路时间及空间调节性,从而识别该信号网络是如何引起成熟的神经再生。增殖的神经干细胞在完全成熟并整合进DG存在的神经网络后有助于记忆的方式尚待研究,相反,该研究提出,Fas信号网络是通过BDNF识别空间工作记忆的瞬时增加是网络的行为结果。总之,本研究对利用光遗传学来发现体内信号传导网络的复杂作用具有重要意义,该网络对于理解神经系统疾病的病理生理学至关重要。
来源:brainnews brainnews
原文链接:https://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649574091&idx=1&sn=20f44535e412baf3a59745997bd5cd3f&chksm=f2edac3fc59a2529dc73494f83abf6eca9bb2a5da5c512b4b877d9dea72a2017cced9b3416ba#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
遗传发育所揭秘神经干细胞的内卷式竞争
第三届全球华人遗传学大会在杭州浙江大学隆重举行


神经干细胞或能转化为血管

利用人多能性干细胞产生脊髓神经干细胞
移植神经干细胞功能整合研究取得进展
广州生物院揭示神经干细胞分化新机制

DNA新技术可筛查新生儿193种疾病
中国遗传学会遗传诊断分会成立大会10月27日在上海召开


新研究:自闭症与神经干细胞功能障碍

移植成体神经干细胞可控制机体老化