科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-01
来源:BioArt
mRNA翻译过程中出现问题将会导致核糖体停滞(Ribosome stalling)以及碰撞(Collision)进而引发一系列质量控制过程。但是目前关于核糖体碰撞引发的广泛的细胞响应是什么样的还未见详尽的研究。
为了对这一问题进行解析,2020年6月30日,美国约翰霍普金斯大学医学院Rachel Green研究组发文题为Ribosome Collisions Trigger General Stress Responses to Regulate Cell Fate,揭开了核糖体碰撞在信号转导以及细胞命运调节过程中意想不到的作用。

细胞应激引发从激活促进细胞存活的途径到启动程序性细胞死亡等广泛的反应。一般来说,细胞应激首要反应的主要是细胞适应并从特定的应激中恢复;如果刺激性损伤不能被解决,细胞就会启动死亡信号通路。细胞对环境或细胞内应激作出适当反应的能力是决定细胞命运的关键。
核糖体碰撞已经被证明是真核细胞针对有问题的mRNA产生的核糖体介导的质量控制触发器【1】。核糖毒性应激反应(Ribotoxic stress response, RSR)在翻译发生问题的时候会被触发,但是具体激活该反应的分子机制还并不清楚。核糖体碰撞可以通过翻译延伸抑制剂比如ANS(anisomycin)或者EME(emetine)在细胞中的使用而产生【2,3】。因此,为了对RSR的激活机制进行研究,作者们为几种翻译延伸抑制剂设置了不同的使用条件发现高浓度的抑制剂会导致核糖体在mRNA上均匀停滞而中间浓度只会使一部分核糖体停滞,进而导致停滞核糖体与其他核糖体产生广泛的碰撞(图1)。
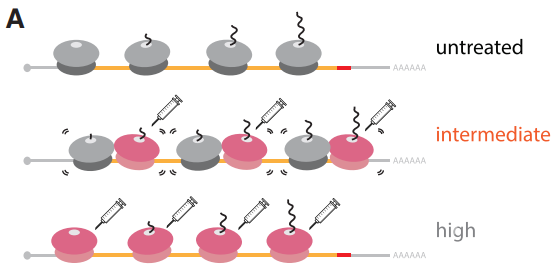

图1 中间浓度翻译延伸抑制剂的使用导致核糖体碰撞的广泛出现并且促进RSR反应产生
在建立起能够监测核糖体碰撞过程的体系后,作者们首先希望检测SAPK(Stress-activated protein kinases)信号途径是否被激活。在加入不同浓度的抑制剂后,作者们惊奇地发现只有中间浓度的抑制剂能够最大程度的提高SAPK信号通路中p38/JNK的磷酸化水平,而高浓度的抑制剂则不会引起明显的变化。这说明核糖体碰撞而非其他过程会激发细胞的RSR反应。
先前研究表明MAPKKK中ZAK作为上游激酶连接核糖毒性应激反应与SAPK的激活【4】。因此,作者们希望探究ZAK是否对核糖体碰撞引发的SAPK激活具有作用。ZAK具有两种主要的蛋白亚型分别称为ZAKα和ZAKβ。在构建了ZAK KO的细胞品系后,作者们发现只有ZAKα而非ZAKβ可以回补核糖体碰撞诱发p38磷酸化的现象。而且,ZAK是经典的MAPKKK并通过自磷酸化作用发挥作用,作者们发现核糖体碰撞会促进ZAKα的自磷酸化并且其激酶活性对于自磷酸化过程非常关键。进一步地,作者们希望探究ZAKα是如何在核糖体碰撞过程去驱动RSR反应产生的。通过多核糖体谱以及Western blot作者们发现ZAKα会直接感应并结合到碰撞核糖体上并由自磷酸化事件激活。
细胞应激通常会通过下调翻译开始,然后通过激活特定的基因表达程序使细胞恢复。先前的研究发现核糖体停滞诱导GCN2介导的eIF2α的磷酸化【5】。因此,作者们想知道核糖体碰撞知否会引起eIF2α的磷酸化。通过加入转录延伸抑制剂,作者们发现在中间浓度的抑制剂加入后eIF2α出现明显的磷酸化水平增加,而在加入GCN2抑制剂后这种增加会被抑制。另外,在敲除ZAK后,eIF2α磷酸化水平在核糖体碰撞中也会降低。这说明ZAK对于核糖体碰撞引发的GCN2介导的eIF2α磷酸化起着非常关键的作用。通过CRISPR为基础的筛选作者们确认核糖体碰撞会激活应激反应途径的相关因子。而且,除了翻译延伸抑制剂之外氨基酸饥饿以及UV射线引发的核糖体碰撞过程均会触发RSR反应。
由此,作者们提出了一个细胞危险程度度量模型(图2):在未受到应激胁迫的细胞中,基础水平的核糖体碰撞由RQC(Ribosome-mediated quality control complex)以及NGD(No-go decay)机制处理;在细胞受到中等水平的核糖体碰撞后会触发ZAK依赖的GCN2介导的翻译起始阻滞以减少进一步地碰撞,促进细胞恢复和存活;而一旦引起危险水平的核糖体碰撞,细胞将启动ZAK依赖的细胞凋亡过程。
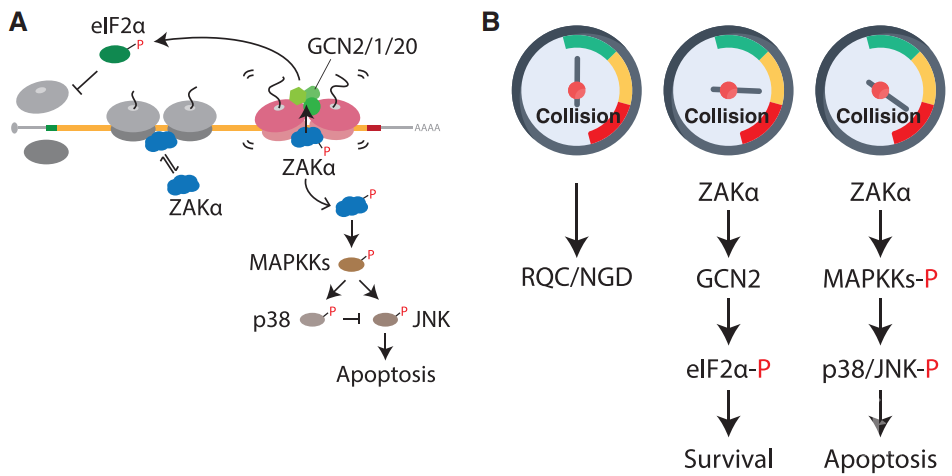
图2 细胞在不同核糖体应激条件下触发的反应
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652489402&idx=3&sn=8b857d90a1446d45451e80d4f5e79cb1&chksm=84e2550eb395dc18a87c7f9f6e493cd1258e6102d4500ced6848e2350d6cc07f01ba4ca954ff#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Mol Cell | 王斌博士等揭示生物钟反馈环路中的磷酸化密码
Science丨生长因子调控NADP+合成的新途径

【大师讲堂】诺奖得主Edmond H. Fischer:磷酸化与去磷酸化调控的生物网络

NAR : 中科院植物所研究团队揭示叶绿体核糖体RNA甲基化修饰的机制和功能
研究揭示叶绿体核糖体RNA甲基化修饰的机制和功能

第166期泰山科技论坛——科技成为牡丹的“真国色”

老是昏昏欲睡?原来是脑蛋白磷酸化在作祟

Nat Biotech:“机器学习”帮助鉴定磷酸化位点
核糖体研究有望延长“健康寿命”

植物所科研人员揭示叶绿体核糖体RNA甲基化修饰的机制和功能