科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-02
来源:BioArt
责编 | 兮
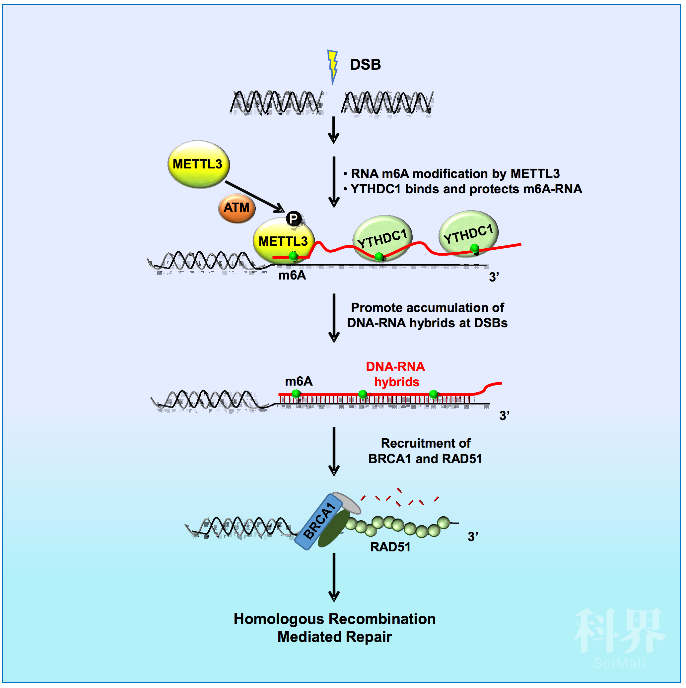
图:METTL3及m6A修饰的RNA促进同源重组修复DNA双链断裂的分子机制。
原文链接:
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652490166&idx=6&sn=a1e5c963e3098c505855cc3c5da76797&chksm=84e25a02b395d314c610791f2c3f0ff3cb534e933dad39ea205d61a9100f518babac07868b0c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

科学家探索物种间DNA组成多样性背后的奥秘

酒精造成DNA损伤的新修复通路

修复人类DNA损伤 科学家从植物中找到新线索

细胞修复DNA损伤新机制揭示

中科院生态中心DNA损伤修复研究取得进展

袁健组发现BRD9调控DNA损伤修复新机制

新研究揭开人类头发曲直的秘密

DNA到底能不能预测外貌?

汪海林研究组在DNA损伤修复研究方面取得重要进展

DNA机器人一小步 癌症治疗一大步